
【题目】下图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法错误的是

A. 充电时,a为电源正极
B. 充电时,Cl-向Bi电极移动,Na+向NaTi2(PO4)2电极移动
C. 充电时,新增入电极中的物质:n(Na+):n(Cl-)=1:3
D. 放电时,正极的电极反应为BiOCl+2H++3e-=Bi+Cl-+H2O
【答案】C
【解析】
充电时,Bi电极上,Bi失电子生成BiOCl,反应为Bi+Cl-+H2O-3e-=BiOCl+2H+,则Bi为阳极,所以a为电源正极,b为负极,NaTi2(PO4)2为阴极得电子发生还原反应,反应为NaTi2(PO4)2+2Na++2e-=Na3Ti2(PO4)3,放电时,Bi为正极,BiOCl得电子发生还原反应,NaTi2(PO4)2为负极,据此分析解答。
A.充电时,Bi电极上,Bi失电子生成BiOCl,Bi为阳极,则a 为电源正极,A正确;
B.充电时,Cl-向阳极Bi电极移动,Na+向阴极NaTi2(PO4)2电极移动,B正确;
C. 充电时,Bi电极上的电极反应为Bi+Cl-+H2O-3e-=BiOCl+2H+,NaTi2(PO4)2电极上,反应为NaTi2(PO4)2+2Na++2e-= Na3Ti2(PO4)3,根据得失电子守恒,新增入电极中的物质:n(Na+):n(Cl-)=3:1,C错误;
D.放电时,Bi为正极,正极的电极反应为BiOCl+2H++3e-=Bi+Cl-+H2O,D正确;
故合理选项是C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是()

A. d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D. a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为________、电子数为___________。
(2)硅主要以硅酸盐、___________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以___________相结合,其晶胞中共有8个原子,其中在面心位置贡献__________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为___________________________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是___________________________。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为_________,化学式为__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成医药中间体X和Y。
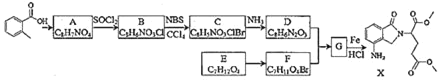
已知:①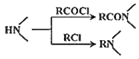 ;②
;②![]() ;③
;③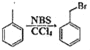
请回答:
(1)下列说法正确的是___。
A.化合物A不能使酸性KMnO4溶液褪色
B.化合物C能发生加成、取代、消去反应
C.化合物D能与稀盐酸发生反应
D.X的分子式是C15H18N2O5
(2)化合物B的结构简式是___。
(3)写出D+F→G的化学方程式___。
(4)写出化合物A(C8H7NO4)同时符合下列条件的同分异构体的结构简式___。
①分子是苯的二取代物,1H﹣NHR谱表明分子中有4种化学环境不同的氢原子
②分子中存在硝基和![]() 结构
结构
(5)设计E→Y(![]() )的合成路线(用流程图表示,无机试剂任选)___。
)的合成路线(用流程图表示,无机试剂任选)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于水解反应或水解方程式不正确的是 ( )
①HCl+H2O![]() H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O![]() H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3—+H2O=CO32—+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O![]() NH3·D2O+H+
NH3·D2O+H+
A.①②③④B.①②③C.②③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中不正确的是
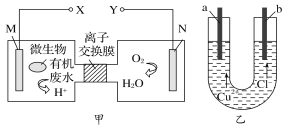
A. a极应与X连接
B. N电极发生还原反应,当N电极消耗11.2 L(标准状况下) O2时,则a电极增重64 g
C. 不论b为何种电极材料,b极的电极反应式一定为2Cl--2e-=Cl2↑
D. 若废水中含有乙醛,则M极的电极反应为:CH3CHO+3H2O-10e-=2CO2↑+10H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
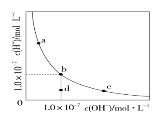
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H<0
(1)图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程![]() 曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
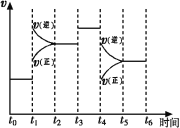
t4时改变的条件是________________。
现进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)反应在0—10分钟内以氮气浓度变化表示的反应速率为___________,该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L/span>,则此时V正_____V逆 (填“>”“<”或“=”)。
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______(填“甲”“乙”或“丙”)。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。
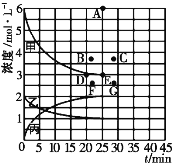
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com