
����Ŀ����ͼΪԪ�����ڱ���һ���֣������Ԫ�آ٩�����ͼ�е�λ�ã��û�ѧ����ش��������⣺ 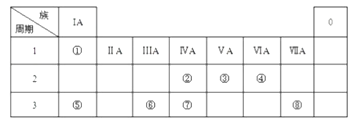
��1���ܡ��ݡ������Ӱ뾶�ɴ�С��˳��Ϊ ��
��2���ڡ��ۡ��ߵ���ۺ������������ǿ������˳���� ��
��3���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ�� ��
��4����ͼ������Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬���������Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ������ţ� ��
A.MnO2
B.KMnO4
C.Na2SO3
D.FeCl3
��5���ڡ��ۡ��ܵ���̬�⻯����ȶ�����ǿ������˳���� ��
���𰸡�
��1��O2����Na+��Al3+
��2��HNO3��H2CO3��H2SiO4
��3��![]() ��
�� ![]()
��4��AD
��5��H2O��NH3��CH4
���������⣺��Ԫ�����ڱ���λ�ÿ�֪����ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪS����ΪCl����1���ܡ��ݡ������Ӱ뾶�ɴ�С��˳��ΪO2����Na+��Al3+ �� ���Դ��ǣ�O2����Na+��Al3+����2���ڢ���C��Si����ͬ����Ԫ�أ�����Ԫ�������ɣ����ϵ�������������Ӧˮ���������������H2CO3��H2SiO3 �� ��ΪN���ǽ���N��C��Ԫ�صķǽ�����Խǿ����Ӧ�ĸ��������Ӧˮ���������Խǿ���������ԣ�HNO3��H2CO3 �� ���Դ��ǣ�HNO3��H2CO3��H2SiO4����3���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ������NaOH��NaClO�ȣ���Ӧ�ĵ���ʽ�ֱ�Ϊ ![]() ��
�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� ![]() ����4�����������ڶ������̻��Ȼ����������·ֽ�����������B��C����������ⷢ��������ԭ��Ӧ�����Դ��ǣ�AD����5���ǽ�����O��N��C����Ӧ�⻯����ȶ���ΪH2O��NH3��CH4 �� ���Դ��ǣ�H2O��NH3��CH4 ��
����4�����������ڶ������̻��Ȼ����������·ֽ�����������B��C����������ⷢ��������ԭ��Ӧ�����Դ��ǣ�AD����5���ǽ�����O��N��C����Ӧ�⻯����ȶ���ΪH2O��NH3��CH4 �� ���Դ��ǣ�H2O��NH3��CH4 ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A�����ĺ����������ͬ��ͬѹ�£�A�������Ҵ�����������ܶ���2��13.8gA��ȫȼ�պ�����ȼ�յIJ���ͨ����ʯ�ң���ʯ�ҵ�����������30.6g������ȼ�ղ���ͨ��Ũ���ᣬŨ���������������10.8g������13.8gA�����������Ƴ�ַ�Ӧ���������������Ϊ5.04L����״������ͨ������ȷ��A����Է�������������ʽ���ṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�̼���仯������ת������Դ�ij�����á���̼����������Ҫ�����ã�
��1����֪����CH4��g��+H2O��g��CO��g��+3H2��g����H1=+206.1kJmol��1
��2H2��g��+CO��g��CH3OH��l����H2=��128.3kJmol��1
��2H2��g��+O2��g��2H2O ��g����H3=��483.6kJmol��1
25��ʱ���ں��ʵĴ��������£����ü��������һ���ϳ�Һ̬�״����Ȼ�ѧ����ʽΪ ��
��2�����÷�Ӧ�����Ʊ�������Ϊ��̽���¶ȡ�ѹǿ�Է�Ӧ�����ʡ�ת���ʵ�Ӱ�죬ijͬѧ�������������Ա�ʵ�飨�¶�Ϊ400���500�棬ѹǿΪ101kPa��404kPa����
ʵ����� | �¶ȡ� | ѹǿ/kPa | CH4��ʼŨ��/molL��1 | H2O��ʼŨ��/molL��1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
��ʵ��2��ʵ��3��ȣ���ƽ�ⳣ����ϵ��K2K3�����������������=������
�ڽ������ʵ�����CH4��ˮ��������1L�����ܱ������У�����������Ӧ����400���´ﵽƽ�⣬ƽ�ⳣ��K=27����ʱ������CO���ʵ���Ϊ0.10mol����CH4��ת����Ϊ ��
��3����ѧ�������CO2�� ȡ C��̫���ܹ�����ͼ1��ʾ��
�١�����ϵͳ�������ķ�Ӧ��n��FeO����n��CO2��=6��1����Fe xOy�Ļ�ѧʽΪ ��
�ڡ��ȷֽ�ϵͳ����ÿ�ֽ�l mol Fe xOy �� ת�Ƶ��ӵ����ʵ���Ϊ �� 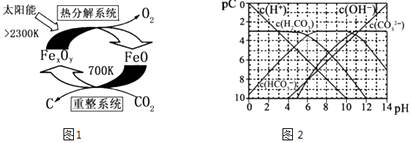
��4��pC����pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ø�����ֵ����ij��Һ�����ʵ�Ũ��Ϊ1��10��3molL��1 �� �����Һ�����ʵ�pC=��lg��1��10��3��=3����ͼ2Ϊ25��ʱH2CO3��Һ��pC��pHͼ����ش��������� ��������Ũ��С��10��5mol/L������Ϊ�����Ӳ����ڣ���
����ͬһ��Һ�У�H2CO3��HCO3����CO32������ܡ����ܡ����������森
����H2CO3һ������ƽ�ⳣ������ֵKa1= ��
������ѪҺ����Ҫͨ��̼�����λ�����ϵ ![]() ���Ե����������ά��pH=7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�
���Ե����������ά��pH=7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е� ![]() ���ս� ��
���ս� ��
A�����B����СC����������D�����жϣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʽ��ͬ�����Ȳ���ͬϵ�Ҳ����ͬ���칹����ǣ� ��
A.CH3CH=CH2�� ![]()
B.��Ȳ�ͱ�
C.![]() ��
�� ![]()
D.����������ѿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦA+B�TC+D�������仯��ͼ��ʾ������˵����ȷ���ǣ� �� 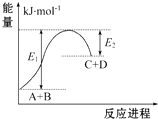
A.�÷�ӦΪ���ȷ�Ӧ
B.�÷�Ӧ���յ�����Ϊ��E1��E2��
C.��Ӧ��������������������������
D.�÷�Ӧֻ���ڼ��������²��ܽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������X�����Y���壬�������·�Ӧ��
X(g)��2Y(g) ![]() Z(g)����Ӧ�����вⶨ�IJ������ݼ��±���
Z(g)����Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n(X)/mol | n(Y)/ mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
����˵����ȷ���ǣ� ��
A.ǰ10 min�ڷ�Ӧ��ƽ������Ϊv(Z)��0.10 mol��L��1��min��1
B.�¶�Ϊ200��ʱ��������Ӧƽ�ⳣ��Ϊ20��������ӦΪ���ȷ�Ӧ
C.���ܱ���������ɱ䣬�����������䣬�ڴﵽƽ�����С�������Ϊԭ��һ�룬��c(X)��1mol/L
D.���������������䣬���������ٳ���1.00 mol X�����1.20 mol Y���壬����ƽ���Xת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ���һ���֣������Ԫ�آ٩�����ͼ�е�λ�ã��û�ѧ����ش��������⣺ 
��1���ܡ��ݡ������Ӱ뾶�ɴ�С��˳��Ϊ ��
��2���ڡ��ۡ��ߵ���ۺ������������ǿ������˳���� ��
��3���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ�� ��
��4����ͼ������Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬���������Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ������ţ� ��
A.MnO2
B.KMnO4
C.Na2SO3
D.FeCl3
��5���ڡ��ۡ��ܵ���̬�⻯����ȶ�����ǿ������˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1 molij�������������������ᷴӦ,�ų�1.12LH2����״��������ת��Ϊ����Arԭ�ӵĵ��Ӳ�ṹ�����ӣ��ý���Ԫ����Ԫ�����ڱ��е�λ����
A���������ڵ�IA�� B���������ڵ�IA��
C���������ڵڢ�A�� D���������ڵڢ�A��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com