
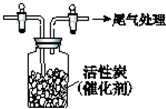
 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.分析 I.根据在化合物中,元素化合价的代数和为零进行解答;
Ⅱ.浓硫酸具有吸水性,可以干燥氯气;
Ⅲ.(1)①SO2Cl2与H2O反应生成硫酸和氯化氢;
②氯离子与银离子反应生成不溶液硝酸的氯化银沉淀,注意应先加入硝酸钡溶液,先排除硫酸根离子的干扰;
(2)SO2和Cl2生成SO2Cl2的反应为可逆反应,SO2Cl2分解得到的氯气和二氧化硫在水溶液中发生氧化还原反应生成硫酸和氯化氢,硫酸与氯化钡反应生成硫酸钡沉淀,SO2和Cl2生成SO2Cl2的反应为可逆反应.
解答 解:I.SO2Cl2中,氧为-2价,氯为-1价,根据在化合物中,元素化合价的代数和为零可知硫元素化合价为+6价;
故答案为:+6;
II.要收集干燥的氯气应除去氯气中的水蒸气,选用浓硫酸可以干燥氯气;
故答案为:浓硫酸;
Ⅲ.(1)SO2Cl2与水反应的方程式:①SO2Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
②要检验溶液中的氯离子应排除硫酸根离子的干扰,所以:取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,若产生白色沉淀,则说明溶液中有Cl-;
故答案为:取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,若产生白色沉淀,则说明溶液中有Cl-;
(2)SO2和Cl2生成SO2Cl2的反应为可逆反应,SO2Cl2分解得到的氯气和二氧化硫在水溶液中发生氧化还原反应生成硫酸和氯化氢,硫酸与氯化钡反应生成硫酸钡沉淀,SO2和Cl2生成SO2Cl2的反应为可逆反应,化学方程式为:SO2+Cl2$\stackrel{活性炭}{?}$SO2 Cl2;
故答案为:①BaSO4;②SO2+Cl2$\stackrel{活性炭}{?}$SO2 Cl2.
点评 本题主要考查了二氧化硫的性质,题目难度中等,明确物质的性质是解题关键,注意离子检验的方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
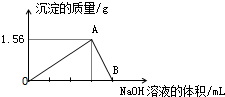 向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水泥、陶瓷、玻璃是三大重要的硅酸盐产品 | |
| B. | 水玻璃是建筑行业经常使用的黏合剂 | |
| C. | 高纯度的硅被用于制作光导纤维 | |
| D. | 水晶、石英的主要成分是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中,高氯酸的酸性最强 | |
| B. | 水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱 | |
| C. | 在冰醋酸中1mol/L的高氯酸的电离度约为0.4% | |
| D. | 在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 生石灰作干燥剂是物理变化 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | “血液透析”利用了胶的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出,氧化性:Cu2+>Fe3+ | |
| B. | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成该电极为阳极 | |
| C. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果偏低 | |
| D. | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 该溶液中一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com