
【题目】某研究小组探究SO2和Fe(NO3)3溶液的反应。请回答:
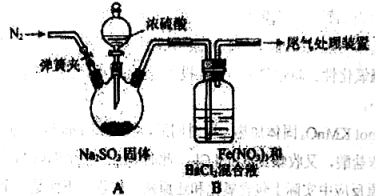
(1)A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是 。
(2)装置B中产生了白色沉淀,其成分是 。
已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:
假设1:SO2与Fe3+反应;
假设2:在酸性条件下SO2与NO3-反应;
假设3: 。
【设计方案、验证假设】
(3)某同学设计实验验证假设2,请帮他完成下表中内容。
实验步骤 | 预期的现象和结论 |
①测定B中实验所用混合溶液的__________ ②配制具有相同 的稀硝酸与BaCl2的混合液并通入适当的 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
经验证假设2成立,则验证过程中发生的离子方程式是 。
(提示:NO3-在不同条件下的还原产物较复杂,此条件未见气体产生)
【思考与交流】
若假设1、假设2都成立,你是否同意假设3,并简述理由 。
【答案】
(1)排尽装置内的空气;
(2)BaSO4 Fe3+、NO3-同时氧化SO2;
(3)①pH ②pH N2(或其它不反应的气体);4SO2+NO3-+5H2O+4Ba2+=4BaSO4↓+NH4++6H+(未写Ba2+与BaSO4也对);否;未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+
【解析】
试题分析:(1)二氧化硫具有还原性,为了防止二氧化硫被空气中的氧气氧化,A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,将装置内的空气排尽,故答案为:排尽装置内的空气;
(2)二氧化硫具有还原性,铁离子具有氧化性、酸性条件下硝酸根具有强氧化性,二氧化硫被氧化生成硫酸根离子,进而生成硫酸钡沉淀,Fe3+具有氧化性,酸性条件下NO3-也具有强氧化性,观点3:SO2和Fe3+、酸性条件下NO3-都反应,故答案为:BaSO4;SO2和Fe3+、酸性条件下NO3-都反应;
(3)某同学设计实验验证假设2,步骤为①测定B中实验所用混合溶液的pH;②配制具有相同pH的稀硝酸与BaCl2的混合液并通入适当的氮气;③将SO2通入上述溶液中,若出现白色沉淀则假设2成立;若不出现白色沉淀则假设2不成立;若假设2成立,则二氧化硫被硝酸根离子氧化为硫酸根离子,进而生成硫酸钡沉淀,反应的离子方程式为4SO2+NO3-+5H2O+4Ba2+=4BaSO4↓+NH4++6H+;若假设1、假设2都成立,则假设3不能成立,原因是未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+,故答案为:①pH ②pH N2(或其它不反应的气体);4SO2+NO3-+5H2O+4Ba2+=4BaSO4↓+NH4++6H+(未写Ba2+与BaSO4也对);否;未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+。


科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2(g)+3H2(g)![]() 2NH3(g) △H<0,达到平衡后,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) △H<0,达到平衡后,当单独改变下列条件后,有关叙述错误的是( )
A. 加催化剂,v正、v逆都发生变化且变化的倍数相等
B. 加压,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
C. 降温,v正、v逆都减小,且v正减小倍数小于v逆减小倍数
D. 加入氩气,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.MgF2晶体中的化学键是共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
D.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象广泛存在于有机化合物中。下列有关同分异构体的说法正确的是
A.具有相同结构式
B.具有相同分子式
C.具有不同相对分子质量
D.具有不同原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中,从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,能加快溶出率的操作有 、 。(写出两条)
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴,则浸出钴的离子反应方程式为 (产物中只有一种酸根)。请从反应原理分析不用盐酸浸出钴的主要原因 。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用: ; 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下:a.6.72LCH4气体
b.3.01×1023个HCl气体分子
c.13.6gH2S气体
d.0.2molNH3
下列对这四种气体的关系从大到小的排列是(用上述序号表示).
①四种气体的物质的量 ;
②标准状况下四种气体的密度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的说法正确的是
A.化学键主要包括离子键、共价键和氢键等
B.离子键是阴、阳离子通过静电作用而形成的化学键
C.任何离子键在形成过程中必定有电子的得与失
D.非金属元素的原子之间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列事实不能用勒夏特列原理解释的是( )
2NH3(g) △H<0。下列事实不能用勒夏特列原理解释的是( )
A.温度过高对合成氨不利
B.合成氨在高压下进行是有利的
C.高温及加入催化剂都能使合成氨的反应速率加快
D.增加N2的浓度可提高平衡混合物中NH3的产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com