
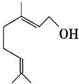
 香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )| A. | 香叶醇的分子式为C10H18O | B. | 不能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生加成反应不能发生取代反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
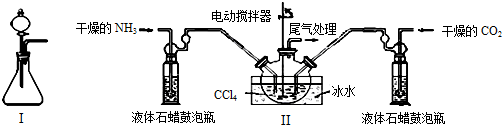
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,46 g乙醇中含有的共价键总数为8 NA | |
| B. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性较大的元素在化合物中只能形成负价,不能形成正价 | |
| B. | 若元素X的第一电离能比元素Y的第一电离能小,则X的金属活动性不一定强于Y | |
| C. | H元素与F元素的电负性差值达1.9,所以HF属于离子化合物 | |
| D. | 某元素原子外围电子排布式为3d64s2,则此元素可能易显+2和+3价,且+3价稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
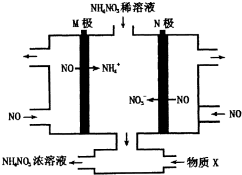
| A. | M极连接直流电源的正极 | |
| B. | 阳极上的电极反应为:NO-3e-+4OH-=NO3-+2H2O | |
| C. | 为使电解产物全部转化为NH4NO3浓溶液,需补充的物质X,则X为NH3 | |
| D. | 装置中加入稀NH4NO3溶液的目的是为了提高溶液的导电能力,可用NaNO3溶液代替 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com