
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3 . ①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式 . 已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH= .
②泡沫灭火器中通常装有NaHCO溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式 .
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1 , CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是 . A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收.吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示: 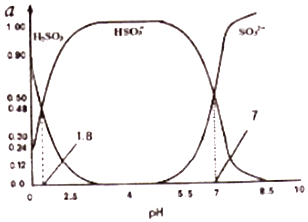
①图中pH=7时,溶液中离子浓度关系正确的是 .
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣ )+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣ )>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3=2H++SO32﹣的平衡常数的数值 .
【答案】
(1)CO32﹣+H2O?HCO3﹣+OH﹣;9;3HCO3﹣+Al3+=Al(OH)3↓+3CO2↑
(2)c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣); AD
(3)A;0.27
【解析】解:(1)①CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式为:CO32﹣+H2OHCO3﹣+OH﹣,水解常数Kh= ![]() =2×10﹣4,当溶液中c(HCO3﹣):c(CO32﹣)=20:1时,c(OH﹣)=10﹣5mol/L,由水的离子积Kw可知,c(H+)=10﹣9mol/L,所以pH=﹣lg10﹣9=9,
=2×10﹣4,当溶液中c(HCO3﹣):c(CO32﹣)=20:1时,c(OH﹣)=10﹣5mol/L,由水的离子积Kw可知,c(H+)=10﹣9mol/L,所以pH=﹣lg10﹣9=9,
所以答案是:CO32﹣+H2OHCO3﹣+OH﹣;9;
②Al2(SO4)3与NaHCO3混合时能相互促进水解生成氢氧化铝沉淀、二氧化碳气体,离子方程式为Al3++3HCO3﹣═Al(OH)3↓+3CO2↑,
所以答案是:3HCO3﹣+Al3+=Al(OH)3↓+3CO2↑;(2)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量浓度为0.1mol/L,溶液B为0.1molL﹣1的CH3COONa溶液;
HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,溶液B碱性大于A溶液,两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣),
A.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相等,故正确;
B.溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减弱,不能调节溶液pH相等,故错误;
C.溶液B碱性大于A溶液,向溶液B中加适量NaOH,溶液pH更大,故错误;
D.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH相等,故正确;
所以答案是:c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣);AD;(3)①A、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32﹣)+c(HSO3﹣)+c(OH﹣),中性溶液则c(H+)═c(OH﹣),则c(Na+)═2c(SO32﹣)+c(HSO3﹣),所以c(Na+)>2c(SO32﹣),而图可知pH=7时,c(SO32﹣)=c(HSO3﹣),则c(Na+)>2c(SO32﹣)>c(HSO3﹣),故A 正确;
B、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32﹣)+c(HSO3﹣)+c(OH﹣),中性溶液则c(H+)═c(OH﹣),则c(Na+)═2c(SO32﹣)+c(HSO3﹣),c(SO32﹣)≠c(H2SO3),故B错误;
C、pH=7时,c(H+)=c(OH﹣),故C错误;
D、SO32﹣+H2OHSO3﹣+OH﹣,HSO3﹣H++SO32﹣,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3﹣)=c(SO32﹣)>c(H+)=c(OH﹣),故D错误;所以答案是:A;
②亚硫酸的第一步电离方程式为:H2SO3H++HSO3﹣,根据图象可知,pH=0时,亚硫酸浓度为0.9mol/L,亚硫酸氢根离子浓度为0.24mol/L,此时氢离子浓度为1mol/L,则Ka1= ![]() ≈0.27,所以答案是:0.27.
≈0.27,所以答案是:0.27.


科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下: 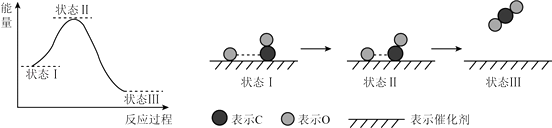
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe + CuSO4 = Cu + FeSO4。下列有关该反应的说法正确的是
A.Fe是氧化剂B.CuSO4 为还原剂
C.Fe被还原D.CuSO4 发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Na2SO4、NaCl、MgCl2的1L混合溶液c (Na+) = 0.5 mol/L,c(Cl-)=0.4 mol/L,c(Mg2+)= 0.15 mol/L则此溶液中c (SO42-)为
A.0.15 mol/LB.0.2 mol/L
C.0.3 mol/LD.0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如图: 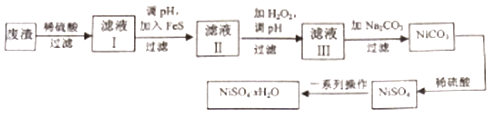
(1)在待镀件上镀镍时,待镀件应作极,电镀过程中电解质溶液浓度 (填“增大”、“减小”、“不变”)
(2)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为 . 当Zn2+恰好沉淀完全时,在CuS、ZnS共存的混合液中c(Zn2+)=10﹣5mol/L,则c(Cu2+)=mol/L (已知Ksp(CuS)=1.3×10﹣36 , Ksp(ZnS)=1.6×10﹣24).
(3)对滤液Ⅱ中先加H2O2再调pH,调pH的目的是 .
(4)滤液Ⅲ溶质的主要成分是NiSO4 , 加入Na2CO3过滤后再加适量稀硫酸溶解又生成NiSO4 , 这两步操作的目的是 .
(5)为测定NiSO4xH2O晶体x的值,称取26.3g晶体加热至充全失去结晶水,剩余固体15.5g,则x的值等于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol/L的盐酸分别滴定体积相同且浓度均为0.10mol/L的三种一元碱XOH、YOH及ZOH,滴定曲线如图所示。

下列说法正确的是
A. 滴定XOH时可用酚酞作指示剂
B. YOH是强碱
C. X++H2O![]() XOH+H+的平衡常数K=10-4
XOH+H+的平衡常数K=10-4
D. [V(盐酸)/V(碱)]=0.5时,c(Z+)>c(Y+)>c(X+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氧化还原反应的分析中合理的是 ( )
A.Mg变为MgO时化合价升高,因此,Mg在该反应中被氧化
B.非金属单质在反应中只作氧化剂
C.肯定有一种元素被氧化,另一种元素被还原
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是( )
A.pH=0的溶液:Fe2+、Mg2+、NO3﹣、SO42﹣
B.由水电离出的c(H+)=1×10﹣13mol/L的溶液:Al3+、K+、SO42﹣、Cl﹣
C.![]() =1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣
=1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣
D.pH=14的溶液:Na+、K+、Al3+、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图。下列有关该电池说法不正确的是
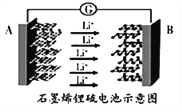
A. 金属锂是所有金属中比能量最高的电极材料
B. 充电时A电极为阴极,发生还原反应
C. 充电时B电极的反应:Li2S8-2e-=2Li++S8
D. 手机使用时电子从A电极经过手机电路版流向B电极,再经过电池电解质流回A电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com