
��������(��Ҫ�ɷ���Al2O3)�������Ĺ�������ʾ��ͼ����:

(1)������ɵ���������Һ������(��ϲ㡱���²㡱),���ʱ�������ĵĵ缫������(���������������)��
(2)д��ͨ�����������̼�ữʱ��Ӧ�����ӷ���ʽ:������������������������������������������
(3)����� ����ʱ,��������ʯ(Na3AlF6),����
����ʱ,��������ʯ(Na3AlF6),���� ��������������������������,��ҵ�Ͽ����÷��������塢���������ʹ����ڸ��������·�����Ӧ����ȡ����ʯ,д���÷�Ӧ�Ļ�ѧ����ʽ:����������������������
��������������������������,��ҵ�Ͽ����÷��������塢���������ʹ����ڸ��������·�����Ӧ����ȡ����ʯ,д���÷�Ӧ�Ļ�ѧ����ʽ:����������������������
(4)����������������������������Fe��Si������,���õ�ⷽ����һ���ᴿ,�õ��ص���������������(�ѧʽ),�����ĵ缫��ӦΪ�������������������� ������
������
(5)�Խ�����Ʒ���п���ʴ����,���ӳ���ʹ��������
�ٿ���һ���������е��(����ͼ),��ʱ��������γ��������������Ĥ,��缫��ӦΪ����������;

�ڸֲĶ�����,�ܷ�ֹ�ֲĸ�ʴ,��ԭ��������������������������������������������
.�淶����:(1)�²㡡����
(2)Al+CO2+2H2O Al(OH)3��+HC
Al(OH)3��+HC
(3)���ۼ�(���ۻ��¶�)��2Al(OH)3+12HF+3Na2CO3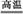 2Na3AlF6+3CO2+9H2O
2Na3AlF6+3CO2+9H2O
(4)Al��Al-3e- Al3+
Al3+
(5)��2Al-6e-+ 3H2O
3H2O Al2O3+6H+�������ܵ�������Ĥ���ű����ڲ�����������;���Ʋ������,��������Һ�Ӵ�
Al2O3+6H+�������ܵ�������Ĥ���ű����ڲ�����������;���Ʋ������,��������Һ�Ӵ� ʱ�γ�ԭ���,����������ֹ�ֲı���ʴ
ʱ�γ�ԭ���,����������ֹ�ֲı���ʴ
����:(1)���ڱ���ʯ(Na3AlF6)���������������ܶȱ�����С,�������� ����Һ���²㡣���ʱ������̼�������ɵ�����������(2)NaAlO2��Һ��ͨ�����CO2����Al(OH)3��NaHCO3��(3)Al2O3���۵�ܸ�,�ۻ���Ҫ�϶�����,�������ʯ���Խ���Al2O3���ۻ��¶ȡ����������غ㶨����д�û�ѧ����ʽ��(4)����ͨ����⾫��¯��ȥ���к��е�����,��������ΪAl,������Al�ŵ硣(5)����������ĤΪAl2O3,��˵缫��ӦΪ2Al-6e-+3H2O
����Һ���²㡣���ʱ������̼�������ɵ�����������(2)NaAlO2��Һ��ͨ�����CO2����Al(OH)3��NaHCO3��(3)Al2O3���۵�ܸ�,�ۻ���Ҫ�϶�����,�������ʯ���Խ���Al2O3���ۻ��¶ȡ����������غ㶨����д�û�ѧ����ʽ��(4)����ͨ����⾫��¯��ȥ���к��е�����,��������ΪAl,������Al�ŵ硣(5)����������ĤΪAl2O3,��˵缫��ӦΪ2Al-6e-+3H2O Al2O3+6H+���ڸֲĶ���,���ܵ�����Ĥ���Ա����ڲ����,��ʹ�Ʋ�����,�γ�ԭ���ʱ,Al��Ϊ����,�Կɷ�ֹ�ֲĸ�ʴ��
Al2O3+6H+���ڸֲĶ���,���ܵ�����Ĥ���Ա����ڲ����,��ʹ�Ʋ�����,�γ�ԭ���ʱ,Al��Ϊ����,�Կɷ�ֹ�ֲĸ�ʴ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ijǿ������XO(OH)2+��Na2SO3��ԭ�������ԭ2.4��10-3mol XO(OH)2+������30mL 0.2mol/L��Na2SO3��Һ����ôXԪ�ر���ԭ��ļ�̬��
A.+2 B.+1 C.0 D.-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ƽ���������������۴������������η�ˮ��˼·�������������η�ˮ����ԣ�ʹ��pH>12��Ȼ��������������ۡ����裬�Ӷ�ʵ��Ԥ��Ŀ�ġ������ж���������
��A����ˮ����ʱ������ת��ΪAl3+��B����ˮ�����У��������α���ԭ
��C�����������У�OHһ�����˷�Ӧ��D�����ۿ�����СӰ���ˮ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
.����һ�������������MgSO4�Ļ����Һ����μ���Ba(OH)2��Һ����������������m�����Ba(OH)2�����ʵ���n֮��Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. 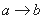 ʱ�ij����ɷ�ΪBaSO4��Mg(OH)2
ʱ�ij����ɷ�ΪBaSO4��Mg(OH)2
B. 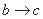 ʱ���������ӷ�ӦΪH++OH-=H2O
ʱ���������ӷ�ӦΪH++OH-=H2O
C. c��ʱ����Һ��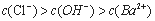
D. ԭ�����Һ�У�n(HCl)=2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijС��ȡһ��������Fe SO4����,����ͼ��װ�ý���ʵ�顣
SO4����,����ͼ��װ�ý���ʵ�顣
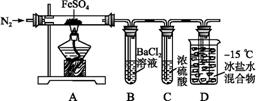
| ʵ����� | ʵ������ | |
| �� | ͨ��һ��ʱ��N2,���� | A�й����Ϊ����ɫ,B���а�ɫ����,D�Թ�������ɫҺ�� |
| �� | �ô��л��ǵ�ľ������װ��D�ĵ��ܿ� | ľ����ȼ |
| �� | ��ַ�Ӧ, | �����ܽ�,��Һ�ʻ�ɫ |
| �� | ����������Һ����D�Թ��� | ��Һ��Ϊdz��ɫ |
��֪:SO2�۵�Ϊ-72 ��,�е�Ϊ-10 ��;SO3�۵�Ϊ16.8 ��,�е�Ϊ44.8 �档
(1)ʵ��۷�Ӧ�����ӷ���ʽ����������������������������������������
(2)�ֽ���̳�����ʹľ����ȼ��������,����A�й�����ɫ�仯�Ʋ�,��һ������������,��������������
(3)ʵ��ܷ�Ӧ�����ӷ���ʽ��������������������������������������������������������
(4)ijͬѧ����B�е�����,��ΪFeSO4 �ֽ�һ����SO3���ɡ�����Ϊ�Ƿ���ȷ,��ԭ����������������(�ñ�Ҫ�����ֺͻ�ѧ����ʽ����)��
�ֽ�һ����SO3���ɡ�����Ϊ�Ƿ���ȷ,��ԭ����������������(�ñ�Ҫ�����ֺͻ�ѧ����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A�������£�0.05 mol��L��1Fe2(SO4)3��Һ�к�Fe3+��ĿΪ0.1 NA
B����״���£�22.4L�ױ��к�C��H��ĿΪ8 NA
C�����¡���ѹ�£�1.6g O2��O3������У���ԭ�ӵ���ĿΪ0.1NA
D��0.1mol Na2O2������CO2��Ӧʱ��ת�Ƶĵ�����ĿΪ0.2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ڣ�Te��Ϊ��A��Ԫ�أ��ǵ�����¼����²��ϵ���Ҫ�ɷ�֮һ����ҵ�Ͽɴӵ�⾫��ͭ������������ȡ�ڡ�
��1����ͭ�к���Cu������Zn��Ag��Au��TeO2�������������⾫��������������Ҫ����TeO2�������������ʼ������������⾫����ͭʱ�������缫��ӦʽΪ____________��
��2��TeO2���������������ˮ��������ǿ���ǿ�����������������ȡ�ڵ�һ�ֹ����������£�
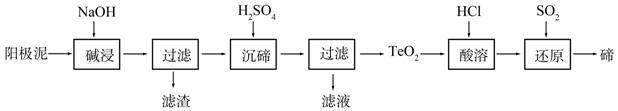
�١������ʱTeO2������Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
�ڡ����ڡ�ʱ������Һ��pHΪ4.5-5.0������TeO2���������H2SO4��������Һ��ȹ��������ڵij���
����ȫ��ԭ����____________________________________����ֹ�ֲ���ȹ���IJ���������_______________________________________________________________��
�ۡ����ܡ���SO2ͨ��TeCl4��Һ�н��С���ԭ���õ��ڣ��÷�Ӧ�Ļ�ѧ����ʽ��
______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijϩ���Ľṹ��ʽΪ
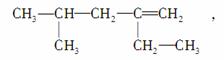
�мס��ҡ���������λͬѧ�ֱ�������Ϊ��2��4�һ�4��ϩ��2�춡��1��ϩ��2,4����3��ϩ��4��2�һ�1��ϩ�������4λͬѧ�������ж���ȷ����(����)
A��������������ѡ���Ǵ����
B���ҵ������ж�����̼ԭ�ӵı���Ǵ����
C����������������ѡ������ȷ��
D��������������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����β����CO��NOx �Լ�ȼú�����е�SO2���Ǵ�����Ⱦ������ǵ�����������Ҫ���塣
��CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ��H1= —574 kJ·mol- 1 ��
CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ��H2= һ1160 kJ·mol- 1
(1)����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
������SO2��NO�����Na2S2O4��NH4NO3��Ʒ������ͼ����(CeΪ��Ԫ��)��

(2)װ�â��У����������£�NO��Ce 4+ �����IJ�����Ҫ��NO3- ��NO2- ��д��ֻ����NO3- �����ӷ���ʽ ��
(3)װ�â������֮һ������Ce4+����ԭ������ͼ��ʾ��
�����ɵ�Ce4+ �ӵ��۵� (����ĸ���)��������
������S2O42 - �ĵ缫��ӦʽΪ ��
(4)��֪����װ�â�����Һ�У�NO2- ��Ũ��Ϊa g·L- 1 ��Ҫ
ʹ1m3����Һ�е�NO2- ��ȫת��ΪNH4NO3����������װ�â�
��ͨ���״���µ�O2 L��(�ú�a����ʽ��ʾ����������������)


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com