
| A、AgCl发生了氧化反应 |
| B、可用于海上照明供电 |
| C、若将镁换成铝,也可构成海水原电池 |
| D、电子由镁电极流出 |


科目:高中化学 来源: 题型:
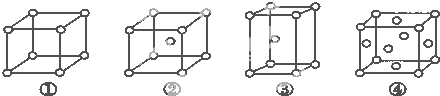
| A、①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积 |
| B、每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个 |
| C、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| D、空间利用率的大小关系为:①<②<③<④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
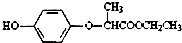 是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )| A、该有机物的分子式为C11H14O4 |
| B、该有机物具有7种不同化学环境的氢原子 |
| C、该有机物能与NaOH溶液反应,生成3种有机物 |
| D、1mol该有机物完全燃烧,将消耗12.5molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一 |
| B、N2中π键与σ键之比为1:2 |
| C、反应③中每生成标况下的22.4 L N2转移电子数1.5NA |
| D、NH3的沸点比PH3的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、锂离子电池与传统铅蓄电池相比,具有高比能量(比能量指的是单位重量或单位体积的能量)的特点 |
| B、废旧锂离子电池先进行“放电处理”让Li+进入石墨(C6)中而利于回收 |
| C、放电时,正极锂的化合价未发生改变 |
| D、充电时电池正极上发生的反应为:LiCoO2-x e-═Li1-x CoO2+xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:N3->Na+>H+ |
| B、反应①和②都是氧化还原反应 |
| C、反应①和②氧化剂都是H2O |
| D、Na3N和NaH与盐酸反应都只生成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol CO2 |
| B、标准状况下44.8 L H2 |
| C、3 NA 个水分子 |
| D、1 L 1 mol/L的硫酸钠溶液中所含的溶质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com