
 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:| 深度/mol•L-1 时间/min | C(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
分析 (1)依据热化学方程式中物质的量和焓变计算反应的氨气物质的量,结合转化率=$\frac{消耗量}{起始量}$计算;
(2)依据反应过程中一氧化氮随反应进行浓度增大,达到平衡状态浓度不变分析;
(3)①先根据v=$\frac{△c}{△t}$计算一氧化氮的反应速率,再根据同一可逆反应中,同一时间段内,各元素的反应速率之比等于其计量数之比确定氧气的反应速率;
②先分析图表,再根据外界对化学平衡的影响分析;
③根据浓度商与化学平衡常数的相对大小判断移动方向;
(4)依据原子守恒配平书写化学方程式;
(5)根据盖斯定律来计算反应的焓变,进而书写热化学方程式.
解答 解:(1)如果将4molNH3和5molO2放入容器中,达到平衡时放出热量0.8akJ,则
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),△H=-akJ•mol-1
起始量 4mol 5mol 0 0
焓变 4mol aKJ
放热 n 0.8aKJ
n=3.2mol
氨气转化率=$\frac{3.2mol}{4mol}$×100%=80%,
故答案为:80%;
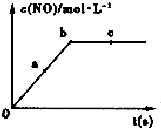
(2)容积固定的密闭容器中进行上述反应,NO的浓度与时间关系分析可知随反应进行,一氧化氮随反应进行浓度增大,达到平衡状态浓度不变,开始投的反应物,反应物的浓度最大,所以速率关系为:v(a正)>v(b逆)=v(c正),
故答案为:v(a正)>v(b逆)=v(c正);
(3)①反应在第2min到第4min时,则v(O2)=$\frac{4.5mol/L-3mol/L}{4min-2min}$=0.75mol/(L.min),
故答案为:0.75mol/(L.min);
②根据生成物第2min及第4min时物质的量浓度的变化量知,第2min到第4min时反应速率增大,且平衡向正反应方向移动,则第2min时改变了条件,使用催化剂反应速率增大,最后达到平衡状态,故选D;
③第4min时,各种物质的浓度不变,说明该反应达到平衡状态,化学平衡常数K=$\frac{{2}^{4×}{3}^{6}}{{2}^{4}×3{\;}^{5}}$=3.0,在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,Q=$\frac{{2}^{4}×{2}^{6}}{2{\;}^{4}×2{\;}^{5}}$=2<3,则平衡向正反应方向移动,
故答案为:正反应方向进行;
(4)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,同时产生CO2,则尿素与NO、NO2三者等物质的量反应的化学方程式为:CO(NH2)2+NO+NO2$\frac{\underline{\;70-95℃\;}}{\;}$N2+CO2+2H2O,
故答案为:CO(NH2)2+NO+NO2$\frac{\underline{\;70-95℃\;}}{\;}$N2+CO2+2H2O;
(5)根据题意:①$\frac{1}{2}$CH4(g)+2NO2(g)=2NO(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-574kJ•mol-1)=-287kJ•mol-1;
CH4(g)+2NO(g)=N2(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-1160kJ•mol-1)=-580kJ•mol-1;
根据盖斯定律反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)可以看成是①+②,CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1,所以△H=-287kJ•mol-1-580kJ•mol-1=-867kJ•mol-1,
故答案为:△H=-867kJ•mol-1.
点评 本题考查了反应热量变化的计算和盖斯定律应用,化学平衡移动原理的分析判断,平衡常数、反应速率计算,掌握基础是关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | +1 164.1 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液中:Al3+、K+、SO32-、Cl- | |
| B. | 加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3- | |
| C. | 能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42- | |
| D. | 由水电离出的[OH-]=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
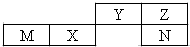 五种短周期元素在元素周期表中的位置如图,其中只有一种为金属元素.下列说法正确的是( )
五种短周期元素在元素周期表中的位置如图,其中只有一种为金属元素.下列说法正确的是( )| A. | 简单离子半径大小:M>N>Z | |
| B. | 最简单气态氢化物的沸点高低:N>Z>Y | |
| C. | M的最高价氧化物可与N的最高价氧化物对应水化物反应 | |
| D. | N单质可与Z的最简单氢化物反应置换出Z单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表前四周期,其中的字母代表相应的元素.
如表为元素周期表前四周期,其中的字母代表相应的元素.| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | k | ||||||||||||||
| h | I | j |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于10.00mL | B. | 小于10.00Ml | C. | 等于10.00mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 石灰乳中滴加稀盐酸 | D. | 硫酸中逐滴加入氢氧化钡溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com