

分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
(2)①依据溶液稀释规律:稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
②浓硫酸稀释过程中产生大量的热,稀释时应将浓硫酸注入水中;
③依据配制溶液体积选择合适规格容量瓶;
(3)分析操作对溶质的物质的量和溶液体积的影响依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)98%,密度1.84g/ml的浓硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;
故答案为:18.4;
(2)①配制480mL溶液,应选择500mL容量瓶,实际配制500mL,设需要浓硫酸体积为V,则依据稀释过程中溶质的物质的量不变计算,18.4mol/L×V=2mol/L×500mL,解得V=54.3mL;
故答案为:54.3;
②浓硫酸稀释的正确操作为:将硫酸沿烧杯壁缓缓注入水中,边加边用玻璃棒搅拌;
故答案为:将硫酸沿烧杯壁缓缓注入水中,边加边用玻璃棒搅拌;
③配制480mL溶液,应选择500mL容量瓶;
故答案为:500;
(3)在定容过程中,某同学加水超过了刻度线后,又用胶头滴管将溶液吸出部分,让液面与刻度线相平,导致溶质的物质的量偏小,则最后所配H2SO4溶液的浓偏低;
故答案为:偏低.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理是解题关键,注意误差分析的方法.


科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测定稀碱溶液的pH,测定值偏小 | |
| B. | 用碱式滴定管量取22.00mL的KMnO4溶液 | |
| C. | 在未知液中滴加BaCl2溶液产生白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中一定含有SO42-或SO32- | |
| D. | 实验室制备氢氧化铁胶体的方法是将氢氧化钠稀溶液滴入饱和氯化铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量的Ba(OH)2溶液时:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 溶液恰好呈中性时:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | SO42-离子恰好完全沉淀时:Al3++SO42-+Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 明矾与Ba(OH)2按物质的量比1:1反应时:Al3++SO42-+Ba2++3OH-═Al(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
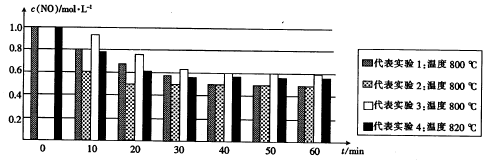
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
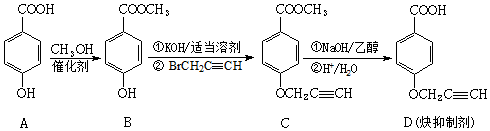
 (中的一种).
(中的一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 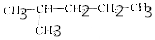 和 和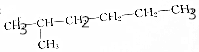 | |
| B. | 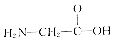 和CH3-CH2-NO2 和CH3-CH2-NO2 | |
| C. | CH3-CH2-CH2-COOH和CH3-CH2-CH2-CH2-COOH | |
| D. | CH3-CH2-O-CH2-CH3和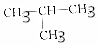 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com