
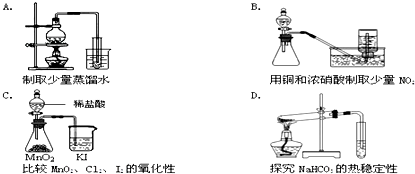


科目:高中化学 来源: 题型:
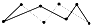 提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=
提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L Cl2完全反应时,转移电子数一定为2NA |
| B、常温下,l LpH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| D、常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
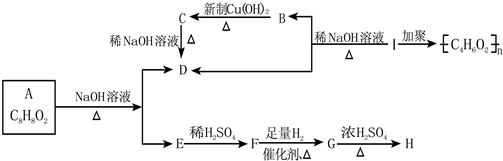 其中F能与FeCl3溶液显紫色,I为一种不饱和酯.
其中F能与FeCl3溶液显紫色,I为一种不饱和酯.查看答案和解析>>
科目:高中化学 来源: 题型:
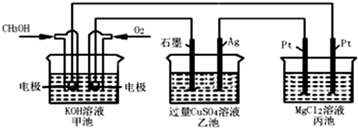
| A、甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B、甲池通入CH3OH的电极反应为CH3OH-6e?+2H2O═CO32?+8H+ |
| C、反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D、甲池中消耗224 mL(标准状况下)O2,此时乙池中银电极上产生1.28g固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com