
| A. | 2HI(g)?H2(g)+I2(g)△H<0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | C(s)+H2O(g)?CO(g)+H2(g)△H>0 | D. | CaCO3(s)?CO2(g)+CaCO3(s)△H>0 |
分析 加压或降温平衡都向正反应方向移动,反应物气体的化学计量数之和大于生成物气体的化学计量数之和,且正反应为放热反应,以此解答该题.
解答 解:A、2HI(g)?H2(g)+I2(g),反应前后气体体积不变,改变压强,不影响平衡,故A错误;
B、N2(g)+3H2(g)?2NH3(g)△H<0,反应物气体的化学计量数之和大于生成物气体的化学计量数之和,加压向正反应方向移动,正反应为放热反应,降温平衡向正反应方向移动,故B正确;
C、C(s)+H2O(g)?CO(g)+H2(g)△H>0,此反应为吸热反应,降温,平衡左移,故C错误;
D、CaCO3(s)?CO2(g)+CaCO3(s)△H>0,此反应为吸热反应,降温,平衡左移,故D错误,
故选B.
点评 本题考查化学平衡的影响因素,题目难度不大,注意影响化学平衡的因素以及外界条件变化时平衡移动的方向.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:解答题
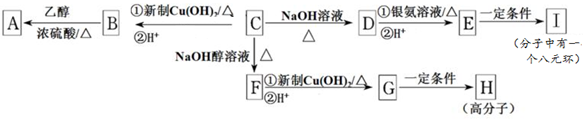
 ,I的结构简式是
,I的结构简式是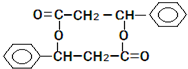 ,
, .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
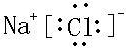 、
、 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于50% | B. | 等于50% | C. | 小于50% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 半径(pm) | 30 | 64 | 66 | 70 | 106 | 108 | 128 | 186 | 232 |
| 主要化合价 | +1,-1 | -1 | -2 | -3,+5 | -2,+4,+6 | -3,+5 | +2 | +1 | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的燃烧热为1256 kJ/mol | |
| B. | 若转移10 mol电子,则消耗2.5 mol O2 | |
| C. | 若生成2 mol 液态水,则△H=-1256 kJ/mol | |
| D. | 若形成4 mol碳氧共用电子对,则放出的热量为1256 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
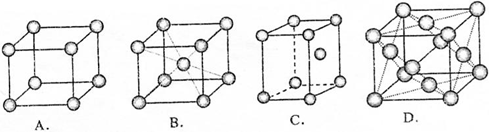
| A. | 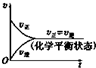 | B. | 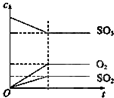 | C. | 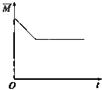 | D. | 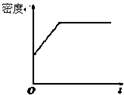 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铜锌原电池中Cu为正极 | |
| B. | 原电池中,化学能转变为电能 | |
| C. | 在原电池中,负极上发生氧化反应,正极上发生还原反应 | |
| D. | 在原电池中,电子从负极经过电解质溶液流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g臭氧中含有氧原子的数目为0.1NA | |
| B. | 6.4g铜片被浓硫酸氧化,失去电子的数目为0.1NA | |
| C. | 标准状况下,11.2LH2O中含水分子的数目为0.5NA | |
| D. | 2 L 0.5 mol•L-1硫酸钾溶液中SO${\;}_{4}^{2-}$离子的数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com