
下列离子方程式中正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO ===BaSO4↓+H2O
===BaSO4↓+H2O
B.向NaOH溶液中滴入少量Ca(HCO3)2溶液:Ca2++HCO +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
C.Na2CO3溶液中通入CO2:CO +CO2+H2O===2HCO
+CO2+H2O===2HCO
D.CH3COOH溶液与NaOH溶液反应:H++OH-===H2O
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原来温度,下列说法正确的是( )
A. 溶液中溶质质量增加,溶剂量减少,溶液的溶质质量分数变大
B. 溶液的pH不变,有氢气放出
C. 溶液中的Na+数目减小,有氧气放出
D. 溶液中的c(Na+)增大,有氧气放出
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验能达到预期目的的是
A.用量筒量取20.00 mL NaOH 溶液
B.向NaOH溶液中加入少量某卤代烃,加热使其充分反应,再滴加几滴硝酸银溶液,观察沉淀的颜色,以此检验该有机物中含有何种卤族元素
C.将碱式滴定管的胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,可排除尖嘴部分的气泡
D.将少量某有机物滴加到新制氢氧化铜悬浊液中,充分振荡,观察是否有红色沉淀生成,若无则证明该有机物中不含醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________;
A.c(H+) B.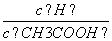 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.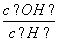
⑵体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图:则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是____________________________________________________,
(3)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A中有锌剩余 ⑥B中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中有错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.实验室制取蒸馏水的装置中,温度计水银球应位于蒸馏烧瓶的支管口处
C.用萃取的方法分离碘水
D.用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
在m g 浓度为c mol·L-1,密度为ρ g/cm3的浓硫酸中加入一定量的水,稀释成浓度为
c/2 mol·L-1的硫酸,则加入水的体积为
A.小于m mL B.等于m mL C.大于m mL D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:
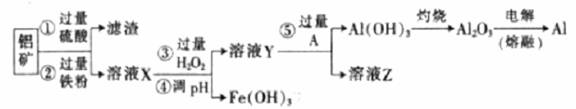
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
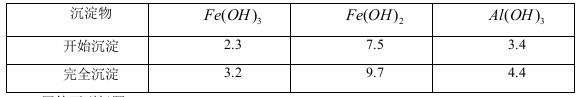
回答下列问题:
(1)滤渣主要成分的化学式为______________________。
(2)灼烧Al(OH)3时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_________。
(4)操作流程中③的离子方程式为_______________________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:

请写出该电池正极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是 .
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的 形成配位键.
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 .
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为 (用元素符号作答).
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为 .
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 (填晶体类型).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com