


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层深蓝色的Fe3O4(也可表示为FeFe2O4)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝。烤蓝时发生如下反应:
![]() ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
![]() ② Na2FeO2+NaNO2+H2O—Na2Fe2O4+NH3↑+NaOH(未配平)
② Na2FeO2+NaNO2+H2O—Na2Fe2O4+NH3↑+NaOH(未配平)
![]() ③ Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
③ Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
![]() 下列说法中正确的是
下列说法中正确的是
![]() A.Fe3O4既可看作是氧化物,又可看作是亚铁盐
A.Fe3O4既可看作是氧化物,又可看作是亚铁盐
![]() B.反应②配平后,H2O的化学计量数为3
B.反应②配平后,H2O的化学计量数为3
![]() C.反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂
C.反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂
![]() D.碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强
D.碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强
查看答案和解析>>
科目:高中化学 来源: 题型:
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层Fe3O4薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝。烤蓝时发生如下反应:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O===Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O===Fe3O4+4NaOH
下列说法中不正确的是
A.Fe3O4既可看做是氧化物,又可看做是亚铁盐
B.反应②配平后,H2O的化学计量数为3
C.反应③是非氧化还原反应
D.碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三10月阶段性测试化学试卷 题型:选择题
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层Fe3O4薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝。烤蓝时发生如下反应:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O===Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O===Fe3O4+4NaOH
下列说法中不正确的是 ( )
A.Fe3O4既可看做是氧化物,又可看做是亚铁盐
B.反应②配平后,H2O的化学计量数为3
C.反应③是非氧化还原反应
D.碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强
查看答案和解析>>
科目:高中化学 来源:2010届云南省高三高考冲刺卷(六)理科综合化学试题 题型:选择题
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层深蓝色的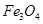 (也可表示为
(也可表示为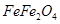 )薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝。烤蓝时发生如下反应:
)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝。烤蓝时发生如下反应:
①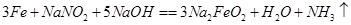
②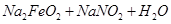 ——
——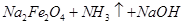 (未配平)
(未配平)
③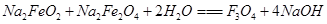
下列说法中,正确的是( )
A.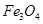 不可看作是氧化物,但可看作是亚铁盐
不可看作是氧化物,但可看作是亚铁盐
B.反应②配平后,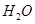 的化学计量数为3
的化学计量数为3
C.反应③中,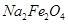 是氧化剂,
是氧化剂,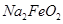 是还原剂
是还原剂
D.碱性条件下,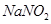 的氧化性比
的氧化性比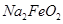 、
、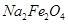 都强
都强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com