
A.△H=△H 1+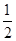 △H 2+ △H 2+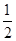 △H 3 △H 3 | B.△H=△H 1+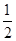 △H 2- △H 2-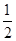 △H 3 △H 3 |
| C.△H=△H 1+2△H 2+2△H 3 | D.△H=2△H 1+△H 2+△H 3 |
科目:高中化学 来源:不详 题型:填空题
 (NH4)2CO3 (aq) △H1
(NH4)2CO3 (aq) △H1 NH4HCO3 (aq) △H2
NH4HCO3 (aq) △H2 2NH4HCO3 (aq) △H3
2NH4HCO3 (aq) △H3
|

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g) ΔH="-221.0" kJ·mol-1
2CO(g) ΔH="-221.0" kJ·mol-1 2H2O(g) ΔH="-483.6" kJ·mol-1
2H2O(g) ΔH="-483.6" kJ·mol-1 CO(g)+H2(g)的ΔH为( )
CO(g)+H2(g)的ΔH为( )| A.+131.3 kJ·mol-1 | B.-131.3 kJ·mol-1 | C.-352.3 kJ·mol-1 | D.+262.6 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )| A.90% | B.80% | C.50% | D.40% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaSO3 | BaSO3 |
| 0.160 | 3.89 | 6.76×10-3 | 5.48×10-9 |
 =____________(写出表达式即可)。
=____________(写出表达式即可)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)
O2(g) H2O(l)ΔH="-285.8" kJ/mol
H2O(l)ΔH="-285.8" kJ/mol CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol
CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。 | 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
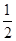 O2 (g)
O2 (g) CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol
CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol 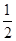 O2 (g)
O2 (g) H2 O(g) ?H2= —120.9kJ/mol
H2 O(g) ?H2= —120.9kJ/mol 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++CN-电离的ΔH为 kJ·mol-1
H++CN-电离的ΔH为 kJ·mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com