
科目:高中化学 来源:2012-2013学年重庆市三峡名校联盟高一下学期期中考试化学试卷(带解析) 题型:填空题
周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm):
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +5,—3 | +3 | +6,—2 | —1 | —2 |
 2AE2(g)已达到平衡状态的是 (填代号)
2AE2(g)已达到平衡状态的是 (填代号)查看答案和解析>>
科目:高中化学 来源:2012-2013学年海南省琼海市嘉积中学高二下教学质量监测二化学卷(带解析) 题型:填空题
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。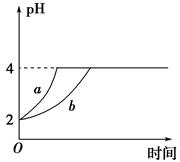
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源:2014届海南省琼海市高二下教学质量监测二化学卷(解析版) 题型:填空题
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。

(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是 (填编号) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届重庆市三峡名校联盟高一下学期期中考试化学试卷(解析版) 题型:填空题
周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm):
元素代号 A B C D E
原子半径/nm 0.075 0.143 0.102 0.099 0.074
主要化合价 +5,—3 +3 +6,—2 —1 —2
F原子中无中子,G在地壳中含量居第二位,H元素焰色反应呈紫色。
请回答下列问题:
(1)B的原子结构示意图为 。
(2)F2C和F2E两种化合物中,沸点较高的是 (填化学式),原因是 。
(3)用电子式表示化合物AF3的形成过程 。
(4)G的单质能与H的最高价氧化物的水化物溶液反应,反应的化学方程式为 。
(5)CE2能使酸性高锰酸钾溶液褪色(有Mn2+生成),写出其反应的离子方程式
。
(6)在2L密闭容器中,一定温度下,能说明反应2AE(g)+E2(g) 2AE2(g)已达到平衡状态的是 (填代号)
2AE2(g)已达到平衡状态的是 (填代号)
a. 2V逆(AE)=V正(E2)
b.容器内压强保持不变
c. 容器内密度保持不变
d. 各组分的物质的量浓度相等
e. 混合气体的平均相对分子质量不再改变
(7)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质溶液含HEF。 则该电池的负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g)![]() 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填
序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。


(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是 (填编号) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com