
分析 (1)元素化合价降低发生还原反应得到还原产物;根据Cl元素化合价变化计算转移电子;
(2)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.1×(7-2)=4a+2b,整理得a+b=0.25-a,当高氯酸钾没有分解时,(a+b)达最大值,当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,根据方程式计算氧气最大值,进而确定(a+b)的最小值.
解答 解:(1)反应中Mn元素化合价由+7价降低为中+2价,故MnCl2是还原产物;产生0.3mol的氯气时,转移电子为0.3mol×2×0-(-1)]=0.6mol,
故答案为:MnCl2;0.6;
(2)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.1×(7-2)=4a+2b,整理得a+b=0.25-a,
当高氯酸钾没有分解时,(a+b)达最大值,故(a+b)的最大值=0.25,
当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.1mol×$\frac{1}{2}$=0.05mol,故a+b≥0.25-0.05=0.2,故(a+b)的最小值为0.2,
故答案为:0.25;0.2.
点评 本题考查混合物计算、氧化还原反应计算,难度中等,注意充分利用整个过程中的电子转移守恒解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定条件反应:2CO(g)?CO2(g)+C(s)可自发进行,则该反应的△H>0 | |
| B. | 向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明硫酸亚铁溶液已变质 | |
| C. | 升高CH3COONa溶液温度,其水的离子积常数和pH值都增大 | |
| D. | 相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3•H2O,水电离程度由大到小的顺序是:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe | B. | Al | C. | Mg | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
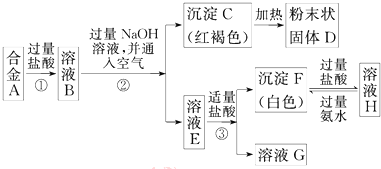
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
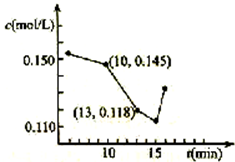 对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:
对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.
,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.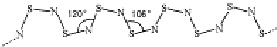
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 石灰石上滴加稀盐酸:CaCO3+2H+═Ca2++H2CO3 | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
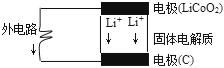 锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )
锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )| A. | 该电池的负极为LiCoO2 | |
| B. | 电池中的固体电解质可以是熔融的氯化钠、干冰等 | |
| C. | 充电时的阴极反应:Li1-xCoO2+xLi++xe-═LiCoO2 | |
| D. | 外电路上的“→”表示放电时的电子流向 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com