
(14分)目前“低碳经济”备受关注。CO2的产生及有效开发利用成为科学家研究的重要课题。试利用所学知识,解决下列问题。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: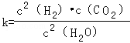 它所对应的化学反应为:_________________
它所对应的化学反应为:_________________
(2)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需的时间/min | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母).
A.=0.8molL﹣1 B.=1.4molL﹣1
C.<1.4molL﹣1 D.>1.4molL﹣1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母).
A.0.6mol、1.0mol、0.5mol、1.0mol
B.0.6mol、2.0mol、0mol、0mol
C.1.0mol、2.0mol、1.0mol、2.0mol
D.0.25mol、0.5mol、0.75mol、1.5mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[ | 500K | 600K | 700K | 800K |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% | 15% |
3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=).
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .若以1.12Lmin﹣1(标准状况)的速率向该电池中通入甲醚(沸点为﹣24.9℃),用该电池电解500mL 2molL﹣1 CuSO4溶液,通电0.50min后,理论上可析出金属铜 g.
科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:选择题
某元素原子的原子核外有三个电子层,最外层上的电子数是另外两个电子层电子数之差,该原子核内质子数为
A.18 B.16 C.8 D.6
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | |||
① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
实验测得反应在起始、达到平衡时的有关数据如下表所示,下列叙述不正确的是
A.容器①中反应达平衡时用XY3表示的反应速率为v(XY3)=1/30moI.L-l·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.若容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
已知:①1 mol H2 分子中化学键断裂时需要吸收 436kJ 的能量
②1 mol Cl2 分子中化学键断裂时需要吸收 243kJ 的能量
③由H原子和Cl原子形成1mol HCl分子时释放 431kJ 的能量,则下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2 (g) + Cl2 (g) =2HCl(g)
B.氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H =+183 kJ·mol-1
C.氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H =-183 kJ·mol-1
D.氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H =-183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:选择题
下列相关实验的现象或结论正确的是
A.向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合质子能力比CO32-强
B.向少量的稀溴水中滴入饱和苯酚溶液立即产生白色沉淀
C.检验废铁屑溶于盐酸后所得的溶液中是否含有Fe2+,可向其中加入酸性KMnO4溶液,根据其是否褪色进行判断
D.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
下表是在相同温度下,三种酸的一些数据,下列说法正确的是
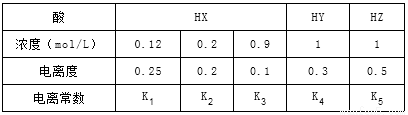
A.相同温度下,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且K1>K2>K3=0.1
B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)×c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.相同温度下,K5>K4>K3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:实验题
(16分)黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应)。某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数。
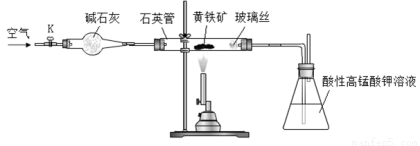
称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100 mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00 mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次。
已知:4FeS2+11O2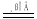 2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
请回答下列问题:
(1)连接好装置,检查装置气密性的操作是 。
(2)通入空气的作用是 。
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数 。(填“偏高”、“偏低”或“不变”)
(4)滴定时,应选择下图中的 (填字母序号)盛装标准H2C2O4溶液,根据 现象来判断滴定已经达到终点。

(5)滴定过程中发生反应的离子方程式是 。
(6)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是 。(保留到小数点后1位)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:选择题
能正确表示下列反应离子方程式的是
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O= 2Al(OH)3↓+ CO32-
B.双氧水中加入稀硫酸和KI溶液:2I﹣+H2O2+2H+=I2+O2↑+2H2O
C.Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+ BaSO4↓
D.草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4 + 2MnO4-+ 6H+ = 2Mn2+ + 10CO2↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三下学期3月一模化学试卷(解析版) 题型:填空题
选做(12分)【化学——物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为______。
②BH4-的空间构型是________(用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用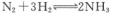 ,实现储氢和输氢。下列说法正确的是________。
,实现储氢和输氢。下列说法正确的是________。
a.[Cu(NH3)4]2+中,N原子是配位原子
b.NH3分子中氮原子的轨道杂化方式为sp2杂化
c.键角NH4+ <NH3
d.相同压强时,NH3的沸点比PH3的沸点高
(3)富氢材料NH3和F2在Cu催化剂存在下反应直接得到NF3
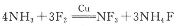
上述化学方程式中的5种物质所属的晶体类型有________(填序号)
a.离子晶体 b.分子晶体
c.原子晶体 d.金属晶体
(4)某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为________________。
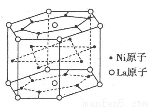
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com