
【题目】已知H3BO3是一元酸,室温时,用1.0mol·L-1的NaOH溶液滴定25.00mL H3BO3溶液的曲线如图所示:
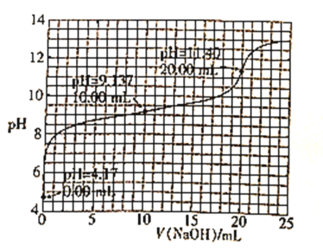
下列说法正确的是( )
A.可用酚酞作滴定指示剂
B.起始时H3BO3的浓度为0.8mol·L-1
C.H3BO3的电离常数数量级为10-5
D.滴定至pH=12时,溶液中:c(OH-)<c(H3BO3)+c(H+)
【答案】B
【解析】
由图像可知当NaOH溶液体积为20mL时,溶液的pH发生突变,此时的反应按化学计量数之比反应,从而可算出H3BO3的浓度,根据起点进一步判断出该酸的强弱和计算出其电离平衡常数。pH=12时,根据电荷守恒和物料守恒可判断溶液中离子浓度的大小关系。
A. 酚酞的变色范围为8~10,由图可知NaOH滴定H3BO3时pH在11.40左右才发生突变,酚酞的变色范围不在pH 的突变范围内,故不能用酚酞作指示剂,A错误;
B. 由分析可知当NaOH加入的体积为20mL时,酸碱恰好完全反应,且H3BO3为一元酸,故n(NaOH)=n(H3BO3),20mL×1mol/L=25mL×c(H3BO3),解得c(H3BO3)=0.8mol/L,B正确;
C. 根据曲线的起点可知H3BO3电离出的H+浓度为10-4.17mol/L,则电离出的B(OH)4-的浓度也为10-4.17mol/L,平衡时H3BO3的浓度为0.8mol/L-10-4.17mol/L≈0.8mol/L,所以K=(10-4.17)2÷0.8=5.7×10-9,数量级为10-9,C错误;
D. 当pH=12时,加入的NaOH的物质的量大于H3BO3的物质的量,
故有c(Na+)>c[B(OH)4-]+c(H3BO3),再根据电荷守恒有c(Na+)+c(H+)= c[B(OH)4-]+c(OH-),联立上述两个式子可得c(OH-)>c(H3BO3)+c(H+),D错误;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验发现,298 K时,在氯化铁酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是

A. 该原电池的正极反应是:Zn-2e-=Zn2+
B. 左烧杯中溶液的红色逐渐褪去
C. 该电池铂电极上立即有气泡出现
D. 该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mA(g)+nB(g)![]() pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
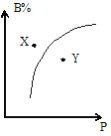
A.m+n>p
B.n>p
C.X点时混合物的正反应速率小于逆反应速率
D.X点比Y点混合物的反应速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式书写正确的是( )
A.NO2通入NaOH浓溶液中:2NO2+2OH-=NO![]() +NO
+NO![]() +H2O
+H2O
B.(CH3COO)2Pb溶液中滴入稀硫酸:Pb2++SO![]() =PbSO4↓
=PbSO4↓
C.NaAlO2溶液中加入少量盐酸:AlO![]() +4H+=Al3++2H2O
+4H+=Al3++2H2O
D.NH4HSO3溶液中加入少量Ba(OH)2溶液:HSO![]() +Ba2++OH-=BaSO3↓+H2O
+Ba2++OH-=BaSO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K的说法中,正确的是( )
A. 在任何条件下,化学平衡常数K是一个恒定值
B. 平衡常数K只与温度有关,与反应物浓度、压强无关
C. 从平衡常数K的大小不能推断一个反应进行的程度
D. 对于可逆反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一定温度下达到平衡时,其平衡常数表达式为
CO(g)+H2(g)在一定温度下达到平衡时,其平衡常数表达式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问题:
(1)上述反应中属于放热反应的是________。
(2)表示H2的燃烧热的化学方程式为________;表示C的燃烧热的化学方程式为_______。
(3)燃烧10 g H2生成液态水,放出的热量为__________。
(4)CO的燃烧热为__________;其热化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示装置中加入一定量的铁粉,分液漏斗中加入一定体积浓度为12 mol·L-1的硝酸,加热打开分液漏斗的活塞,使其充分反应后,
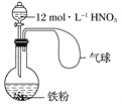
下列微粒:①![]() 、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
、② Fe3+、③H+、④ NO、⑤ NO2,在该装置中一定大量存在的( )
A.①B.①⑤C.②④⑤D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时,三个相同的恒容密闭容器中发生反应CO(g) + H2O(g)![]() CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
CO2(g) + H2(g) K,一段时间后,分别达到化学平衡状态。
容器编号 | 起始浓度/(mol·L1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
Ⅰ | 0.01 | 0.01 | 0 | 0 |
Ⅱ | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
下列说法不正确的是
A.Ⅱ 中达平衡时,c(H2)=0.005 mol·L1
B.III中达平衡时,CO的体积分数大于25%
C.III中达到平衡状态所需的时间比 Ⅰ 中的短
D.若III中起始浓度均增加一倍,平衡时c(H2)亦增加一倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com