
有以下反应:
PCl5(g) PCl3(g)+Cl2(g) ①
PCl3(g)+Cl2(g) ①
2HI(g) H2(g)+I2(g) ②
H2(g)+I2(g) ②
2NO2(g) N2O4(g) ③
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
A.①减少,②不变,③增大 B.均增大
C.①增大,②不变,③减少 D.均不变
科目:高中化学 来源:2015-2016学年江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
能与NaOH溶液,新制Cu(OH)2悬浊液、纯碱溶液、溴水、苯酚钠、甲醇都起反应的是( )
A.CH3COOH B.CH2=CHCOOH C.盐酸 D.乙酸甲酯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
对于可逆反应2SO2(g)+O2(g)==2SO3(g);△H<0,在一恒容容器,由SO2和O2开始反应,下列说法正确的是
A.充入N2容器内压强增大,增加了单位体积内活化分子数,反应速率加快
B.反应进行的净速率是正、逆反应速率之差
C.O2的消耗速率与SO3的生成速率之比为2:1
D.加入SO2,可使单位体积内活化分子百分比增多,加快反应速率
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)830℃,在1L的固定容器的密闭容器中放入1 mol CO和5 mol H2O,反应达平衡后,其化学平衡常数K 1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡 移动。(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为 (选填“正反应方向”、“逆反应方向”、“不移动”)。
【答案】(1)K=c(CO)·c(H2O)/c(CO2)·c(H2) ;(2)吸热 ;(3)等于;
(4)不;(5)逆反应方向。
【解析】
试题分析:(1)化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度幂指数乘积的比。所以该反应的化学平衡常数K= K=c(CO)·c(H2O)/c(CO2)·c(H2) ;(2)根据化学平衡常数与温度的关系可知:升高温度,化学平衡常数增大,说明升高温度,化学平衡向正反应方向移动,正反应方向为吸热反应;(3)化学平衡常数只与温度有关, 加入的反应物的多少无关,由于温度为830℃,属于K=1.0;(4)830℃,容器中的反应达到平衡。在其他条件不变的情况下,扩大容器的体积,即减小压强,由于该反应是反应前后气体体积不变的反应,属于减小压强,化学平衡不发生移动;(5)若1200℃时,当加入上述物质的量浓度的物质时,Qc= c(CO)·c(H2O)/c(CO2)·c(H2)=(4×4)÷(2×2)=4>2.6,所以此时上述反应的平衡移动方向逆反应方向。
考点:考查化学平衡常数的表达式、应用的知识。
【题型】填空题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
I、今有A.醋酸,B.盐酸,C.硫酸三种酸,请用三种酸的序号和“>”“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(2)物质的量浓度均为0.1 mol/L的三种酸溶液的pH由大到小的顺序是 ;如果取等体积的0.1 mol/L的三种酸溶液,用0.1 mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 。
II、用实验确定某酸HB的弱电解质。两同学的方案是:
甲:①称取一定质量的HB配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HB是弱电解质。
乙:①用已知物质的量浓度的HB溶液、盐酸,分别配制pH = 1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HB是弱电解质。
(1)甲方案中,说明HB是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
(2)请你评价乙方案中难以实现之处和不妥之处: 。
III、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。
已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
已知:① 2CO(g)+O2(g) 2CO2(g) △H=-566kJ/mol;
2CO2(g) △H=-566kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) △H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是

A.CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g
B.如上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452 kJ/mol
D.CO的燃烧热为-566 kJ/mol
【答案】A
【解析】
试题分析:A.将①×1/2+②,整理可得CO(g)+Na2O2(s)= Na2CO3(s) △H=-509kJ/mol,即1molCO发生该反应放出热量是509kJ,现在放出热量就是509kJ,则消耗CO的物质的量是1mol,其质量是28g,正确; B.CO生成CO2的反应是放热反应,反应物的能量,图示没有注明物质的状态,不能体系能量变化关系,错误;C.根据反应可知2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452 kJ/mol,若CO2是固体,由于能量比气体低,反应放出的热量小于452 kJ,故2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H>-452 kJ/mol,错误;D.燃烧热是1mol可燃物完全燃烧产生稳定的氧化物时放出的热量,根据①可知CO的燃烧热是-283kJ/mol,错误。
考点:考查反应热的有关计算的知识。
【题型】选择题
【适用】一般
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
下列说法不正确的是
A.稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度
B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液pH约为12
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
反应C(s)+H2O(g)  CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2 使体系压强增大
④保持压强不变,充入N2使容器体积变大
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:填空题
下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
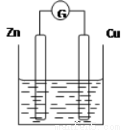
Date:2016.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Cu极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol ⑥正极的电极反应式:Zn―2e―=Zn2+ |
(1)在卡片上,叙述合理的是 (填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是 。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。
(4)如果把硫酸换成硫酸铜溶液,猜测 (填“锌极”或“铜极”)变粗,原因是 (用电极方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成总量的是
①K2SO4 ②CH3COONa ③CuSO4 ④NaNO3
A.①③ B.②④ C.①② D.③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:选择题
关于元素周期律和元素周期表的下列说法,正确的是( )
A. 目前的元素周期表已完善,不可能再有新元素被发现
B. 元素的性质随原子序数的增加而呈周期性变化
C. 化学家道尔顿为元素周期表的建立作出了最巨大贡献
D. 同一主族的元素从上到下,金属性逐渐减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com