
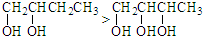
| A. | ①④ | B. | ②④⑤ | C. | ①②③ | D. | ③④⑤ |
分析 烷烃中中,碳原子个数越多其熔沸点越高;烷烃的同分异构体中,支链越少熔沸点越高;能形成氢键的物质熔沸点较高;醇中羟基个数越多其熔沸点越高,据此分析解答.
解答 解:①CH3CH2CH2OH中能形成氢键,丁烷中不存在氢键,所以熔沸点CH3CH2CH2OH>CH3(CH2)2CH3 ,故正确;
②同分异构体中支链越少熔沸点越高,所以熔沸点CH3(CH2)2CH3>CH3CH(CH3)2,故正确;
③苯酚中存在羟基、苯中不存在羟基,所以熔沸点苯酚>苯,故正确;
④乙醇中含有氢键、溴乙烷不含氢键,所以熔沸点CH3CH2Br<CH3CH2OH,故错误;
⑤羟基个数越多,其熔沸点越高,所以熔沸点前者小于后者,故错误;
故选C.
点评 本题考查晶体熔沸点高低判断,为高频考点,晶体熔沸点高低与晶体类型有关、分子晶体熔沸点与相对分子质量及氢键有关,知道常见含有氢键的物质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl-═Cl2↑+2e- | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu═Cu2++2e- | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe═Fe2++2e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 铁极质量不变 | D. | 铜为原电池正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
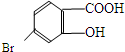 ,它的含氧官能团名称为羧基、羟基.
,它的含氧官能团名称为羧基、羟基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- | |
| B. | 溴乙烷发生水解反应的离子方程式:CH3CH2Br+OH-$→_{△}^{H_{2}O}$CH3CH2O-+H++Br- | |
| C. | 丙烯与水发生加成反应的化学方程式:CH2=CH-CH3+H2O$→_{△}^{催化剂}$CH3-O-CH2-CH3 | |
| D. | 苯酚稀溶液中加入饱和溴水: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 8 | C. | 6 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
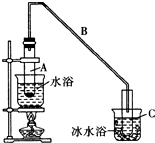 化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.
化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.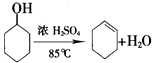
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 难溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高 | B. | 降低 | C. | 不变 | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com