
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
分析 A.元素周期律是核外电子周期性变化的必然结果;
B.原子结构决定元素的性质;
C.同周期第IA族与第VA族位于短周期时原子序数差为4,四和五周期原子序数差为14,六和七周期原子序数差为28;
D.同一主族相邻的两种元素的原子序数之差是2、8、18、32.
解答 解:A.元素周期律是核外电子周期性变化的必然结果,则元素周期表是元素周期律的具体表现形式,故A正确;
B.原子结构决定元素的性质,则元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化,故B正确;
C.同周期第IA族与第VA族位于短周期时原子序数差为4,四和五周期原子序数差为14,六和七周期原子序数差为28,则同周期第IA族与第VA族原子序数之差可能是4、14、28,故C正确;
D.同一主族相邻的两种元素的原子序数之差是2、8、18、32,则同主族原子序数之差可能是:10、16、18、26、34、36、50,故D错误;
故选D.
点评 本题考查元素在周期表的位置及应用,为高频考点,把握原子结构与元素的位置、元素周期律的实质为解答的关键,侧重于学生的分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子数总是从 1~8 重复出现 | |
| B. | 随着原子序数的递增,元素的最高正化合价从+1到+7,负价从-7到-1重复出现 | |
| C. | 第3周期中,随着核电荷数的递增,元素的离子半径依次减小 | |
| D. | 随核电荷数递增,ⅦA族元素单质熔、沸点升高,碱金属元素单质熔、沸点降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
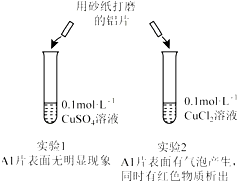
| A. | 由实验1 可以得出结论:金属铝的活泼性弱于金属铜 | |
| B. | 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu | |
| C. | 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因 | |
| D. | 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2mol•L-1的盐酸和硫酸反应,后者更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性NaOH>Mg(OH)2>Al (OH)3 | |
| B. | 原子半径Na>Mg>Al | |
| C. | 阳离子的氧化性Na+<Mg2+<Al3+ | |
| D. | Na与冷水剧烈反应,Mg与冷水反应微弱;镁粉与铝粉分别与同浓度稀HCl反应,镁粉比铝粉反应剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数a>b>c>d | |
| B. | 离子半径D(n+1)->Cn->An+>B(n+1)+ | |
| C. | 单质还原性A>B>C>D | |
| D. | 最高价氧化物对应水化物的碱性B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
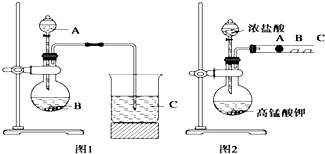 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
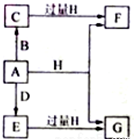 A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性.它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题.
A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性.它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题.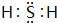 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
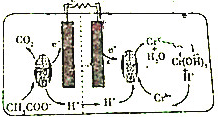 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学品,下列有关说法正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学品,下列有关说法正确的是( )| A. | 该电池能够在高温下工作 | |
| B. | 得到的有价值的化学品为CO2和Cr(OH)3 | |
| C. | 右室中的电极为负极 | |
| D. | 1molCH3COO-转化为CO2得到4mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CS2为V形的极性分子 | |
| B. | Cl03- 的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和SO32- 的中心原子均为sp3杂化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com