
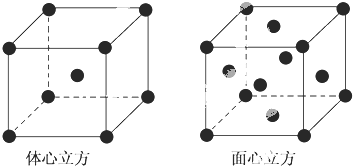
���� ��1��A��ԭ�Ӿ����۷е�ϸ�������̬�����磻
B�����Ӿ����۷е�ϵͣ�����̬�����磻
C�����Ӿ����۷е�ϸߣ�����̬�����磻
D�����������Ӿ�������̬������ˮ�����磻
��2�����Ӿ����۷е�ϵͣ�
��3�����þ�̯��ȷ����������ԭ�Ӹ������Ӷ�ȷ����ԭ�Ӹ���֮�ȣ�
��� �⣺��1��A��̼�����۷е�ϸ�������̬�����磬˵������̬�����ʲ��������룬ֻ������ѧ���Ķ��ѣ�Ϊԭ�Ӿ��壻
B���廯���۷е�ϵ�������̬�����磬˵������̬�����ʲ��������룬ֻ������ѧ���Ķ��ѣ�Ϊ���Ӿ��壻
C����������۷е�ϵ����������Ҵ����ȷ¡���ͪ�У�˵��Ϊ���Ӿ��壻
D���廯��������״̬��ˮ��Һ�ж����磬˵���������ܵ���������ƶ����������ӣ�Ϊ���Ӿ��壻
�ʴ�Ϊ��ԭ�Ӿ��壻���Ӿ��壻���Ӿ��壻���Ӿ��壻
��2���Ȼ����۷е�ϵ���������ˮ��Ҳ���������ѡ���ͪ���л��ܼ������Ȼ������ڷ��Ӿ��壬�ʴ�Ϊ�����Ӿ��壻
��3������������Feԭ�Ӹ���=1+8��$\frac{1}{8}$=2������������Feԭ�Ӹ���=8��$\frac{1}{8}$+6��$\frac{1}{2}$=4����������������������������������ʵ�ʺ��е���ԭ�Ӹ���֮��=2��4=1��2��
�ʴ�Ϊ��1��2��
���� ���⿼�龧�������жϡ����������֪ʶ�㣬���ؿ���ѧ���ȽϷ������ռ���������������Ϥ�����������ͼ����������۷е��С�������þ�̯�����㾧����ԭ�Ӹ�������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Fe | H2O��g�� | Fe3O4 | H2 | |
| ��ʼ/mol | 3.0 | 4.0 | 0 | 0 |
| ƽ��/mol | m | n | p | Q |
| Fe | H2O��g�� | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢۢܢ� | B�� | �٢ۢܢ� | C�� | �٢ڢۢ� | D�� | �٢ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������п��Ӧ�ų��������� | |
| B�� | ����ʹ���ֱ���п��Ӧ�ų�������һ���� | |
| C�� | ������п��Ӧ����ʱ�䳤 | |
| D�� | ����ʹ���ֱ���п��Ӧ����ʱ��һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
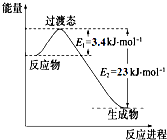 �о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
�о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����| ʵ���� | �¶� �� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com