
【题目】下列说法不正确的是
A. 钠在氧气中燃烧生成的淡黄色的固体Na2O2,可做为呼吸面具的供氧剂
B. 将足量CO2气体通入饱和碳酸钠溶液中,会析出固体
C. 保存硫酸亚铁溶液时应加入一定量的铁粉
D. 向过氧化钠中滴入紫色石蕊试液,溶液先变红后褪色
【答案】D
【解析】
A.根据Na2O2的生成条件和用途来分析;B.碳酸氢钠的溶解度小于碳酸钠;C.亚铁容易被氧化;D.紫色石蕊遇碱变蓝。
A.钠在氧气中燃烧生成的淡黄色的固体Na2O2,过氧化钠与人呼出的二氧化碳发生反应:2Na2O2+2CO2=Na2CO3+O2,可作为呼吸面具的供氧剂,正确;
B.将足量CO2气体通入饱和碳酸钠溶液中,发生反应:Na2CO3+CO2+H2O=2NaHCO3![]() ,其原因是碳酸氢钠的溶解度小于碳酸钠,正确;
,其原因是碳酸氢钠的溶解度小于碳酸钠,正确;
C.硫酸亚铁的铁是正二价,容易被空气氧化成正三价,导致溶液变质,加铁屑可防止溶液中Fe2+被氧化,正确;
D.Na2O2与紫色石蕊试液中的水反应NaOH和O2,NaOH显碱性,使溶液变蓝,但过量Na2O2具有漂白性,又可将蓝色溶液氧化成无色,错误。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学欲利用下图所示的装置验证浓硝酸与木碳反应时有NO2、CO2生成,探究是否还有NO生成。已知二氧化氮易液化(沸点为21.1℃),而NO、CO2难液化。
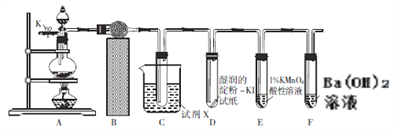
(1)装置连接好后,首先要进行的操作是_________;然后打开开关K,通过导管向装置内通入N2的目的是_________。
(2)B中的试剂是_________,C是用于检验NO2的,试剂X最好是_________(填“水”或“冰水”),D的作用是_________。
(3)若将装置C改为盛有淀粉-KI溶液的试管,也能确定有NO2生成,实验中不用此种方法的原因是_________________;假设E中溶液的颜色慢慢褪去,则E中最可能发生的反应的离子方程式为_________________;若E中没有明显的变化,C、F中出现了预期的现象,则A中反应的化学方程式为_________________。
(4)将等物质的量的NO2、NO通入冰冻的水中只可得到一种比碳酸酸性强的酸,该酸的化学式为_________,设计一种实验方案证明其酸性比碳酸的酸性强_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛分子的结构式如图所示,下列描述正确的是( )
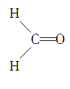
A. 甲醛分子中有4个σ键
B. 甲醛分子中的C原子为sp3杂化
C. 甲醛分子中的O原子为sp杂化
D. 甲醛分子为平面三角形,有一个π键垂直于三角形平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
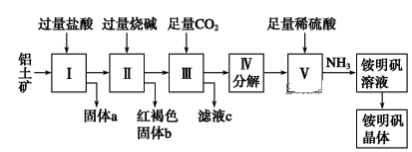
请回答下列问题:
(1)固体a的化学式为________。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________、_____________;Ⅲ中通入足量CO2气体发生反应的离子方程式为_______________。
(3)由Ⅲ中得到滤液c的实验操作为__________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(4)将NH4Al(SO4)2溶液和Ba(OH)2溶液,按物质的量比1:2混合,写出离子方程式为_______________。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法错误的是

A. 单核阴离子的还原性Y强于X
B. W的气态氢化物与其最高价含氧酸反应生成离子化合物
C. X、Y、Z最简单氢化物中稳定性最弱的是Y
D. 在元素周期表中118号元素与Z位于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
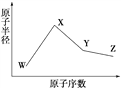
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有_____个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是______(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中有1mol NaHCO3和0.8mol Na2O2,加热充分反应后,容器内残留的固体
A. 0.5molNa2CO3和0.8mol Na2O2 B. 0.5molNa2CO3和1.6molNaOH
C. 0.8molNa2CO3和1molNaOH D. 1molNa2CO3和0.6molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠是生活中常见的物质,请回答下列问题。
(1)碳酸氢钠的俗称是_________,其水溶液显_____性。(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式____________。等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量,前者________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为________________________________。
(4)硫酸亚铁是缺铁性贫血的治疗药物,可用于制备铁盐,实验室检验Fe3+的方法是:向溶液中滴入几滴_________________溶液,观察溶液是否变为血红色。向FeSO4溶液中加入NaOH溶液通常得不到白色的Fe(OH)2沉淀,其原因是_________________________(用化学方程式回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光。该草酸二酯的结构简式如下图所示。下列有关该草酸二酯的说法不正确的是
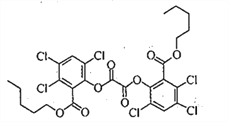
A. 分子中含有一种含氧官能团
B. 苯环上的一溴代物只有一种
C. 可以发生取代反应和加成反应
D. lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com