
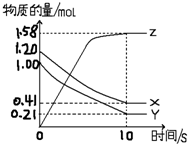
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:分析 (1)根据化学反应中各物质的物质的量变化量与化学计量数之比呈正比书写化学方程式;
(2)根据v=$\frac{△c}{△t}$计算化学反应速率;
(3)A.化学平衡状态是动态平衡,v(正)=v(逆)≠0;
B、在10s之前,反应未达平衡状态;
C、在10s时,反应达到平衡状态;
D、在10s时到达平衡是因为此时正逆反应速率相等;
(4)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变.
解答 解:(1)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,化学反应中各物质的物质的量变化量与化学计量数之比呈正比,
则有Y:X:Z=(1.20mol-0.41mol):(1.0mol-0.21mol):1.58mol=1:1:2,则反应的化学方程式为X+Y?2Z,
故答案为:X+Y?2Z;
(2)反应开始到10s,用X表示的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{1.20mol-0.41mol}{2L}}{10S}$=0.0395mol/(L•s),故答案为:0.0395mol/(L•s);
(3)A.由图可知,l0s后,该反应到达平衡状态,化学平衡状态是动态平衡,v(正)=v(逆)≠0,故A错误;
B、在10s之前,反应未达平衡状态,X的消耗速率大于它的生成速率,故B正确;
C、在10s时,反应达到平衡状态,Y的正反应速率等于逆反应速率,故C正确;
D、在10s时到达平衡是因为此时正逆反应速率相等,但是正反应速率达到最小值,故D错误.
故答案为:AD;
(4)A、Z的生成速率与Z的分解速率相等,说明正逆反应速率相等,故A正确;
B、单位时间生成amolX,同时生成3amolY,都体现正方向,故B错误;
C、X、Y、Z的浓度不再变化,说明正逆反应速率相等,故C正确;
D、X+Y?2Z是一个气体体积不变的反应,混合气体的总压强不再变化,不能说明正逆反应速率相等,故D错误;
E、X+Y?2Z是一个气体体积不变的反应,混合气体的物质的量不再变化,不能说明正逆反应速率相等,故E错误;
F、X、Y、Z的分子数目比为1:1:1,与起始量和转化率有关,故F错误.
故答案为:AC.
点评 本题考查物质的量随时间的变化曲线,以及化学平衡的计算,题目难度中等,注意把握化学方程式的判断方法.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2和10g N2 | B. | 1mol H2O和1g H2O | ||
| C. | 3.2g O2和2.24L的空气 | D. | 22gCO2和3.01×1023个O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
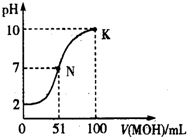 常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )
常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )| A. | 忽略温度影响,滴入MOH溶液过程中,水的电离程度不变 | |
| B. | HA为弱酸,MOH为强碱 | |
| C. | N点MOH过量,故溶液中c(M+)>c(A-) | |
| D. | K点的c(MOH)+c(M+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则A的转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中再加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量当满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足1<b<3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com