
下列操作正确的是( )
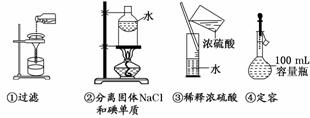
A.只有② B.②③
C.③④ D.全部错误
科目:高中化学 来源: 题型:
三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子。则下列关于三氯化氮的叙述正确的是
A.N元素的非金属性比Cl元素强
B.在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl
C.在NCl3分子中N为—3价,NCl3跟水发生水解反应的产物是NH3和HClO
D.NCl3跟水反应生成NH4Cl、O2和Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
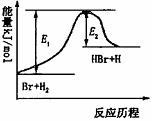
参照反应Br+H2  HBr+H的能量对反应历程的示意图。
HBr+H的能量对反应历程的示意图。
下列叙述正确的是
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:
2X(g)+ 2Y(g)  Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
A.5s内平均反应速率为υ(Y)= 0.2 mol/( L·s)
B.该反应的平衡常数数值为0.5
C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率
D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
| 温度(℃) | 450 | 500 | 550 | 600 |
| SO2的转化率(%) | 97.5 | 95.8 | 90.50 | 80.0 |
(1)由表中数据判断DH 0(填“>”、“=”或“<”)。
(2)能判断该反应已达到平衡状态的依据是 (填序号)。
a.混合气体中各组分的质量不变 b.c(SO2)=c(SO3) c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是 。 ②此时的温度是 ℃。
③此温度下的平衡常数K= (可用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列混合物的除杂方法与发生反应的类型均正确的是( )
| 混合物 | 加入试剂或方法 | 反应类型 | |
| A | 除去O2中的CO | 通入炽热的氧化铜中 | 化合反应 |
| B | 除去CO2中的HCl | 通入饱和碳酸氢钠溶液中 | 复分解反应 |
| C | 除去碳酸钙中的碳酸钠 | 溶解、加入氯化钡溶液 | 复分解反应 |
| D | 除去氯化钠中的碳酸钠 | 加入适量盐酸、蒸发 | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于实验的叙述正确的是( )
A.向过量稀硫酸中加入除去油污的废铁屑,是制备硫酸亚铁的可行方案
B.向碳酸钠粉末中加入少量乙酸溶液,生成大量气泡,说明乙酸的酸性比碳酸强
C.向铝屑与硫酸反应后的溶液中加氨水反应,是制备氢氧化铝的最佳方案
D.向硫酸亚铁铵溶液中,依次加入氯水和硫氰化钾溶液,溶液变红,说明溶液中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在学习了乙酸的性质后,根据甲酸的结构(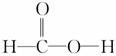 )对甲酸的化学性质进行了下列推断,其中不正确的是
)对甲酸的化学性质进行了下列推断,其中不正确的是
( )
A.能与碳酸钠溶液反应
B.能发生银镜反应
C.不能使KMnO4酸性溶液褪色
D.能与单质镁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
饮用水中的NO 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO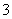 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO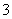 还原为N2,其化学方程式为:
还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH+18H2O===10Na[Al(OH)4]+3N2↑。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)上述反应中,若有10个铝原子参与反应,则转移的电子总数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com