
 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g),发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g).
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g),发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g).| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | K3 |
分析 (1)①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式①×2-②得由此分析解答;
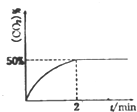
(2)根据图象,反应平衡时二氧化碳的体积分数为50%,则设0-2min内的消耗SO2为xmol,
根据反应的化学反应方程式:2CO(g)+SO2(g)?S(g)+2CO2(g),
开始:4 2 0 0
转化:2x x x 2x
平衡:4-2x 2-x x 2x
则根据平衡时二氧化碳的体积分数为50%,有$\frac{2x}{6}$×100%=50%,则x=1.5mol,
①根据反应速率V=$\frac{△c}{△t}$进行计算;
②a.选用更高效的催化剂,反应速率增大,但平衡不移动;
b.升高温度,反应速率增大,但平衡向逆反应移动;
c.及时分离出二氧化碳,平衡向正反应移动,但反应速率减小;
d.增加SO2的浓度,反应速率增大,平衡向正反应移动
③a.反应物物质的量增加,浓度增大,反应速率加快;
b、物质的量加倍,体积不变,各组分的浓度会加倍;
c、温度不变,平衡常数不变;
d、物质的量加倍,增大压强,平衡正向移动,增加反应物的转化率;
(3)对于放热反应,温度越高,K越小.
解答 解:(1)①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(s)+2CO2(g)△H1=(-283.0KJ•mol-1
)×2-(-296.0KJ•mol-1)=-270KJ•mol-1,
所以其热化学反应方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H1=-270KJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H1=-270KJ•mol-1;
(2)①根据图象,反应平衡时二氧化碳的体积分数为50%,则设0-2min内的消耗SO2为xmol,
根据反应的化学反应方程式:2CO(g)+SO2(g)?S(g)+2CO2(g),
开始:4 2 0 0
转化:2x x x 2x
平衡:4-2x 2-x x 2x
则根据平衡时二氧化碳的体积分数为50%,有$\frac{2x}{6}$×100%=50%,则x=1.5mol;
①0-2min内的平均反应速率v(CO)=$\frac{\frac{3}{2}}{2}$ mol•L-1•min-1=0.75 mol•L-1•min-1,故答案为:0.75 mol•L-1•min-1;
②a.选用更高效的催化剂,反应速率增大,但平衡不移动,故错误;
b.升高温度,反应速率增大,但平衡向逆反应移动,故错误;
b.及时分离出二氧化碳,平衡向正反应移动,但反应速率减小,故错误;
d.增加SO2的浓度,反应速率增大,平衡向正反应移动,故正确;
故选d;
③a、反应物物质的量增加,浓度增大,反应速率加快,达到平衡时间比原来缩短,故错误;
b、压强增大平衡正向移动,CO的平衡浓度为原来的2倍,故正确;
c、平衡常数只受温度影响,温度不变,平衡常数不变,故错误;
d.增大压强平衡正向移动,平衡时SO2的转化率增加,小于原来的2倍,故错误.
故选b;
(3)2CO(g)+SO2(g)?S(g)+2CO2(g)△H<0,对于放热反应,温度越高,K越小,所以K1>K2,
故答案为:>.
点评 本题考查综合考查化学反应与能量变化、化学平衡的计算及其平衡移动的判断,注意掌握三段式法进行计算的方法,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力及化学计算能力,注意键能与反应热的计算关系,题目难度中.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(SO42-),c(OH-)>c(H+) | B. | c(NH4+)=c(SO42-),c(OH-)=c(H+) | ||
| C. | c(NH4+)>c(SO42-),c(H+)>c(OH-) | D. | c(SO42-)>c(NH4+),c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
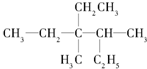 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷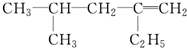
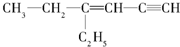 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8查看答案和解析>>
科目:高中化学 来源: 题型:选择题
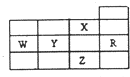
| A. | P亚层未成对电子最多的是Z元素 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W元素的第一电离能小于Y元素的第一电离能 | |
| D. | X元素是电负性最大的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、NaHCO3、NaCl、HCl | B. | Na2CO3、NaHCO3、HCl、NaCl | ||
| C. | (NH4)2SO4、NH4Cl、NaNO3、Na2CO3 | D. | NH4Cl、(NH4)2SO4、Na2CO3、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19世纪初,化学家维勒提出了有机化学的概念 | |
| B. | 自然界存在或不存在的有机物都可以利用人工合成出来 | |
| C. | 有机化合物的定量分析法最早由瑞典化学家贝采里乌斯提出的 | |
| D. | 著名的有机合成化学家李比希曾说:“有机合成的威力体现为在老的自然界旁边再建立起一个新的自然界.” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
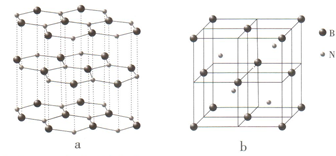 氮元素可形成丰富多彩的物质.
氮元素可形成丰富多彩的物质.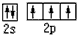 ;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为2:1.
;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为2:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com