
| A. | 戊烷 | B. | 戊烯 | C. | 乙酸乙酯 | D. | 丁醇 |
分析 自身类别相同的同分异构体考虑碳链异构、位置异构来解答.
解答 解:A.戊烷只存在碳链异构,同分异构体为:CH3-CH2-CH2-CH2-CH3, ,
, ,共3种;
,共3种;
B.戊烷的同分异构体有:CH3-CH2-CH2-CH2-CH3、 、
、 ;
;
若为CH3-CH2-CH2-CH2-CH3,相应烯烃有2种:CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3;
若为 ,相应烯烃有3种:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2;
,相应烯烃有3种:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2;
若为 ,没有相应烯烃;共5种;
,没有相应烯烃;共5种;
C.若为甲酸和丙酯,结构有2种:HCOOCH2CH2CH3、HCOOCH(CH3)CH3;若为丙酸和甲酯,结构只有1种:CH3CH2COOCH3;共3种结构;
D.丁醇有4种同分异构体,分别是CH3CH2CH2CH2OH,CH3CH2CHOHCH3,(CH3)2CHOHCH3,(CH3)3COH.
故选:B.
点评 本题考查同分异构体的书写与判断,难度中等,掌握书写的方法以及形成酯的羧酸与醇的同分异构体的判断是解题的关键.


科目:高中化学 来源: 题型:解答题
| 组别 | 草酸的体积(mL) | 温度 | 其他物质 |
| ① | 2Ml | 20 | 无 |
| ② | 2mL | 20 | 10滴饱和MnS04溶液 |
| ③ | 2mL | 30 | 无 |
| ④ | 1mL | 20 | 1mL蒸馈水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用氨水除去试管内壁上的银镜 | |
| B. | 利用乙酸乙酯和乙醇的密度不同,可用分液的方法分离 | |
| C. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| D. | 用氢氧化钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
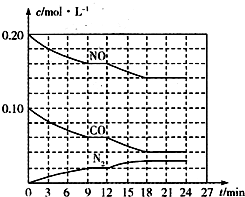 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.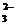 )+c(HSO
)+c(HSO )(用含硫微粒浓度的代数式表示).
)(用含硫微粒浓度的代数式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
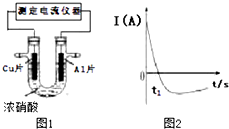 常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )| A. | 0-t1时,正极的电极反应式为:2H++NO3--e-═NO2+H2O | |
| B. | 0-t1时,溶液中的H+向Cu电极移动 | |
| C. | t1时,负极的电极反应式为:Cu-2e-═Cu2+ | |
| D. | t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2 H2O | |
| B. | CH4+2O2$\stackrel{点燃}{→}$CO2+H2O | |
| C. | 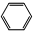 +HO-NO2$→_{△}^{浓硫酸}$ +HO-NO2$→_{△}^{浓硫酸}$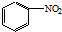 +H2O +H2O | |
| D. | CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com