


分析 (1)同周期中元素原子半径依次减小,稀有气体除外,形成的简单离子,先看电子层,再看核电荷数分析比较,元素对应的单质还原性越弱,对应离子氧化性越强;
(2)R2- 被氧化为R单质,失去电子,而中M元素的化合价降低,得到电子,结合电子守恒计算;
(3)实现固体和液体的分离可以采用过滤的方法;硫酸钡和盐酸不反应,但是亚硫酸钡可以和盐酸反应;硫酸钡是白色不溶于强酸的沉淀,亚硫酸根离子还原性强,容易被氧化为硫酸根离子;
(4)①根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
②在电解池的阳极发生失电子的氧化反应.
解答 解:(1)同周期中元素原子半径依次减小,稀有气体除外,形成的简单离子,先看电子层,再看核电荷数,第三周期元素中形成简单的阴离子为P3-、S2-、Cl-,电子层数相同,核电荷数越大,半径越小,元素对应的单质还原性越弱,对应离子氧化性越强,所以最强的是铝离子,
故答案为:Al3+;
(2)R2- 被氧化为R单质,失去电子,而中M元素的化合价降低,得到电子,M2On2-的还原产物中,M为+3价,
设M2On2-中M元素的化合价为x,
由电子守恒可知,0.15L×0.6mol/L×(2-0)=0.1L×0.3mol/L×2×(x-3),
解得x=6,
M2On2-离子中(+6)×2+(-2)×n=-2,
则n=7,
故答案为:7;
(3)实现固体和液体的分离可以采用过滤的方法,将SO2通入到BaCl2溶液中,出现的白色浑浊可能是硫酸钡还可能是亚硫酸钡,硫酸钡和盐酸不反应,但是亚硫酸钡可以和盐酸反应,溶解,可以用盐酸来鉴别沉淀成分,硫酸钡和盐酸不反应,但是亚硫酸钡可以和盐酸反应,所以白色不溶于盐酸的沉淀物是硫酸钡,硫酸钡沉淀的生成和亚硫酸根离子的不稳定性有关,即2SO2+2Ba2++O2+2H2O═2BaSO4↓+4H+,
故答案为:过滤;HCl;BaSO4;2SO2+2Ba2++O2+2H2O═2BaSO4↓+4H+;
(4)①根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O,
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
②在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,
故答案为:2Cu-2e-+2OH-=Cu2O+H2O.
点评 本题考查学生二氧化硫的以及含硫元素的盐的性质知识,原电池和电解池原理的理解应用,可以根据所学知识来回答,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
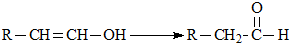 化学式为C9H10O2的有机物A有如下的转化关系
化学式为C9H10O2的有机物A有如下的转化关系
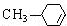 ,H:CH3COOCH=CH2
,H:CH3COOCH=CH2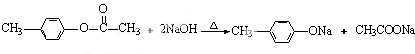
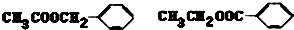 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | 试剂 | 分离方法 | |
| A | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| B | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氢氧化钠(氢氧化钡) | 稀硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液加热蒸干可得无水AlCl3 | |
| B. | 用25ml碱式滴定管量出14.80ml的碳酸钠溶液 | |
| C. | 在中和滴定的实验过程中,目光只应注视滴定管的液面 | |
| D. | 用蒸馏水湿润过的pH试纸测0.1mol/L的醋酸溶液的pH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ①④⑤⑦ | C. | ②③④⑥ | D. | ④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有白烟生成 | |
| B. | 硝酸具有酸的通性,如果与活泼金属反应,会有H2生成 | |
| C. | 浓硝酸能使活泼金属如铝、镁、锌、铁等发生“钝化” | |
| D. | 常温下,铜与稀HNO3反应很慢,是因为发生了“钝化” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
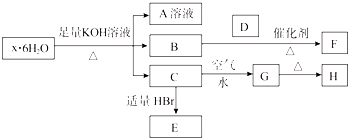
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
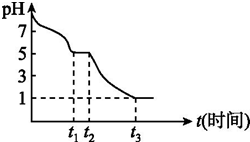
| A. | 一定是碱溶液 | B. | 一定是酸溶液 | ||
| C. | 由水电离出的[OH-]=1×10-9mol•L-1 | D. | pH值可能为9也可能为5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com