
下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
下列关于蛋白质的说法不正确的是 ( )
A.蛋白质是天然高分子化合物
B.通常用酒精消毒,其原理是酒 精使细菌中的蛋白质变性而失去生理活性
精使细菌中的蛋白质变性而失去生理活性
C.浓的Na2SO4溶液能使溶液中的蛋白质析出,加水后析出的蛋白质又溶解,但已失去生理活性
D. 鉴别织物成分是蚕丝还是“人造丝”可采用灼烧闻气味的方法
鉴别织物成分是蚕丝还是“人造丝”可采用灼烧闻气味的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂废液经测定得知主要含有乙醇,其中还有丙酮、乙酸和乙酸乙酯,根据下表中各物质的性质,按下列步骤回收乙醇和乙酸。
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78.5 | 117.9 |
①向废液中加入烧碱溶液,调整溶液的pH=10;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃时的馏出物;④排出蒸馏器中的残液,冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器中进行蒸馏,回收馏出物,请回答下列问题:
(1)加入烧碱使溶液的pH=10的目的是
________________________________________________________________________
________________________________________________________________________。
(2)在70℃~85℃时馏出物的主要成分是__________________。
(3)在步骤④中加入过量浓硫酸的目的是(用化学方程式表
示)________________________________________________________________________
________________________________________________________________________。
(4)当最后蒸馏的温度控制在85℃~125℃一段时间后,耐酸蒸馏器残液中溶质的主要成分是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为__________(填化学式)。
(2)要得到稳定的HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是_________(填序号)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸
(3)工业废水中的NO2-可用铝粉除去.已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质.将氧化剂和还原剂的化学式及其配平后的系数填入下列横线上:_________________________ + _________________________
上述反应后废水的pH值将________(填“增大”、“减小”或“不变”)。
(4)向20mL 0.01mol·L-1的NaNO2溶液中加入10mL 0.01 mol·L-1的AgNO3溶液,一段时间后,溶液中的c(Ag+)=________________________________。(已知:KSP(AgNO2)=2×10-8 mol2·L-2)
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。
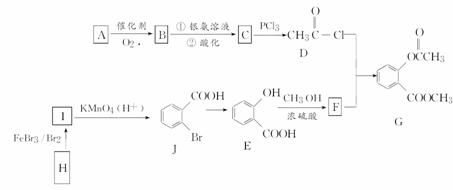
已知: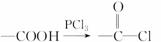
请回答以下问题:
(1)A的结构简式是________。
(2)H→I的化学反应方程式为
________,B与银氨溶液反应的化学方程式是_______________________________。
(3)C→D的反应类型是________,I→J的反应类型是________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是________________________________________________________________________。
(5)满足以下条件的F的同分异构体(含F)共有________(填数字)种。
①能与氯化铁溶液发生显色反应
②红外光谱等方法检测分子中有COO结构
③苯环上有两个取代基
其中能与碳酸氢钠溶液反应且核磁共振氢谱测定有5个吸收峰的同分异构体的结构简式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:某温度时,KW=1.0×10-12。在该温度下,测得0.1mol·L-1Na2A溶液PH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A=H++HA-,HA-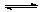 H++A2-
H++A2-
B.常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-)
C.相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等
D.0.0l mol·L-l的NaHA溶液pH>2
查看答案和解析>>
科目:高中化学 来源: 题型:
黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
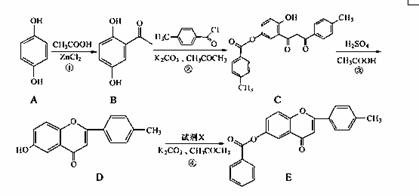
请回答下列问题:
(1)化合物B中的含氧官能团为 和 (填名称)。
(2)反应③中涉及到的反应类型有水解反应、 和 。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为 。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(5)写出反应①的化学方程式 。
(6)已知: 。
。
根据已有知识并结合相关信息,写出以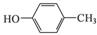 和CH3COOH为原料制备
和CH3COOH为原料制备
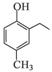 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
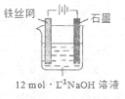
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O 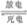 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为 ,正极反应为: 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L,含有2.0×l0-4 mol·L-l K2FeO4的废水中有CaFeO4沉淀产生,理论上至少加入Ca(OH)2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如下图所示。(部分生成物和反应条件已略去)
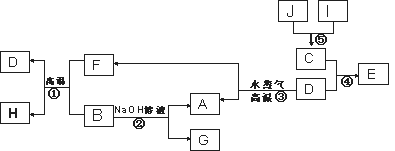
请回答下列问题:
(1) 写出组成物质D的元素在周期表中的位置:___________________。
(2) ①写出反应①的化学方程式:______________________________。
②由E的饱和溶液可以制得胶体,用化学方程式表示该过程的原理是_______________。
③写出反应②的离子方程式_________________________________。
(3) 已知G的水溶液显碱性,其原因是(用离子方程式表示)_________。
(4) J在H2O2分解反应中作催化剂。若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com