
【题目】(1)某烷烃分子中含共价键的数目为16,则该烷烃的分子式为____________,其一氯代物只有一种的烷烃的结构简式为_____________。
(2)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
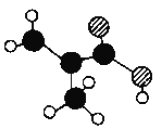
①该物质的结构简式为________________。
②下列物质中,与该物质互为同系物的是(填序号)__________,互为同分异构体的是________。
A.CH3CH=CHCOOH B.CH2=CHCOOCH3
C.CH3CH2CH=CHCOOH D.CH3CH(CH3)COOH
(3)药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。
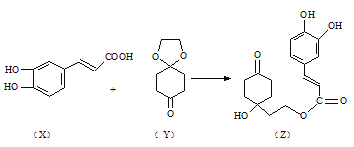
试填空:
① X的分子式为_____________ ;该分子中最多共面的碳原子数为___________ 。
②Y中是否含有手性碳原子______________(填“是”或“否”)。
③1molZ与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠______________mol;1molZ与足量的浓溴水充分反应,需要消耗Br2_____________ mol。
【答案】C5H12 C(CH3)4 CH2=C(CH3)COOH C AB C9H8O4 9 否 3 4
【解析】
(1)烷烃的分子通式为CnH2n+2,含有的共价键数目为3n+1;一氯代物只有一种的烷烃,说明烷烃中等效氢的个数为1;
(2) 由分子模型可知该有机物的结构简式为![]() ,含有碳碳双键和羧基,结合同分异构体以及同系物的定义解答;
,含有碳碳双键和羧基,结合同分异构体以及同系物的定义解答;
(3) ①由结构简式可知分子式,苯环、碳碳双键为平面结构,与其直接相连的原子一定在同一平面内;
②连4个不同原子或基团的C原子为手性碳原子;
③Z中酚-OH、酯基与NaOH反应,碳碳双键能与溴发生加成反应,酚羟基的邻、对位苯环上的氢能被溴原子取代。
(1) 烷烃的分子通式为CnH2n+2,含有的共价键数目为3n+1,即3n+1=16,解得n=5,此烷烃的分子式为C5H12;一氯代物只有一种的烷烃,说明烷烃中等效氢的个数为1,则烷烃的结构简式为C(CH3)4;
(2)①由分子模型可知该有机物的结构简式为![]() ;
;
②该有机物的结构简式为![]() ,与之互为同分异构的有A:CH3CH═CHCOOH、B:CH2═CHCOOCH3,与之互为同系物的有C:CH3CH2CH═CHCOOH;
,与之互为同分异构的有A:CH3CH═CHCOOH、B:CH2═CHCOOCH3,与之互为同系物的有C:CH3CH2CH═CHCOOH;
(3) ①由X的结构简式可知X的分子式为C9H8O4,苯环、碳碳双键为平面结构,与其直接相连的原子一定在同一平面内,单键可以旋转,则9个C原子可能共面;
②连4个不同原子或基团的C原子为手性碳原子,则Y分子中不存在连4个不同原子或基团的C原子,则Y中不含手性碳原子;
③Z中酚-OH、酯基与NaOH反应,则1mol Z与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠3mol;碳碳双键能与溴发生加成反应,酚羟基邻、对位的苯环上的氢能被溴原子取代,则1mol Z在一定条件下与足量Br2充分反应,需要消耗Br2 4mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验小组同学对乙醛与新制的Cu(OH)2反应的实验进行探究。
实验Ⅰ:取2mL 10%的氢氧化钠溶液于试管中,加入5滴2%的CuSO4溶液和5滴5%的乙醛溶液,加热时蓝色悬浊液变黑,静置后未发现红色沉淀。
实验小组对影响实验Ⅰ成败的因素进行探究:
(1)探究乙醛溶液浓度对该反应的影响。
编号 | 实验Ⅱ | 实验Ⅲ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变红棕色,静置后底部有大量红色沉淀 | 加热,蓝色悬浊液变红棕色,静置后上层为棕黄色油状液体,底部有少量红色沉淀 |
已知:乙醛在碱性条件下发生缩合反应:CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
① 能证明乙醛被新制的Cu(OH)2 氧化的实验现象是______。
② 乙醛与新制的Cu(OH)2 发生反应的化学方程式是______。
③ 分析实验Ⅲ产生的红色沉淀少于实验Ⅱ的可能原因:______。
(2)探究NaOH溶液浓度对该反应的影响。
编号 | 实验Ⅳ | 实验Ⅴ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,蓝色悬浊液变红棕色, 静置后底部有红色沉淀 |
依据实验Ⅰ→Ⅴ,得出如下结论:
ⅰ. NaOH溶液浓度一定时,适当增大乙醛溶液浓度有利于生成Cu2O。
ⅱ. 乙醛溶液浓度一定时,______。
(3)探究NaOH溶液浓度与乙醛溶液浓度对该反应影响程度的差异。
编号 | 实验Ⅵ | 实验Ⅶ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,静置后底部有红色沉淀 |
由以上实验得出推论: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
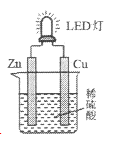
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A.0.5mol羟基中所含电子数为5NA
B.标况下,11.2LCHCl3中,共用电子对的数目为2NA
C.2.8g的乙烯和丙烯(C3H6)中含有的碳原子数为0.2NA
D.1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4NA
)分子中含有碳碳双键的个数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯(Pd)、锌及其化合物在合成酮类物质中有极其重要的作用,如图为合成 的反应过程:
的反应过程:
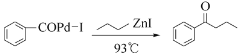
回答下列问题:
(1)I原子价电子排布式为___________,其能量最高的能层是___________(填能层符号)。
(2)H、C、O三种元素的电负性由大到小的顺序为___________。
(3) 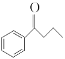 中碳原子的杂化方式为___________。
中碳原子的杂化方式为___________。
(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是___________。
②NH3的空间构型为___________。
③1 mol [Zn(NH3)4]Cl2中含有___________mol σ键。
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的___________。
(6)金属钯的堆积方式如图所示:
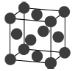
①该晶胞中原子的空间利用率为___________(用含π的式子表示)。
②若该晶胞参数a=658 pm,则该晶胞密度为___________(列出计算表达式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.用惰性电极电解硫酸铜溶液时,若溶液的pH值变为1时,则电极上转移的电子数目为NA
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的方程式正确的是
A.电解氯化镁溶液:2Cl–+2H2O![]() H2↑+Cl2↑+2OH–
H2↑+Cl2↑+2OH–
B.碳酸氢铵溶液中加入足量石灰水:Ca2++![]() +OH–=CaCO3↓+H2O
+OH–=CaCO3↓+H2O
C.Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.氢氧化钡溶液中加入稀硫酸:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
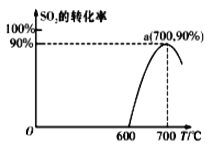
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______molL-1min-1,该温度下的平衡常数为_________.
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______.
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.

石墨I附近发生的反应为__________________________________,当外电路通过1mole-,正极上共消耗_______mol N2O5 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔是一种治疗高血压的药物的中间体,可以通过以下方法合成:
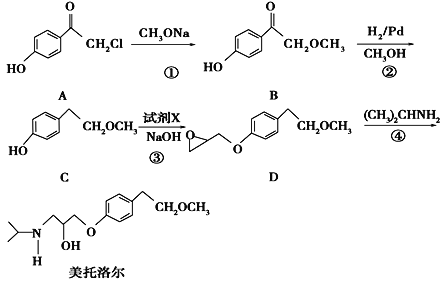
请回答下列问题:
(1)写出C中的官能团的名称为_________________.
(2)美托洛尔的分子式________________.
(3)写出反应①的化学方程式__________________________________________;反应②的反应类型是_____________
(4)反应③中加入的试剂X的分子式为C3H5OCl,X的结构简式为____________________.
(5)满足下列条件的B的同分异构体有有_______种,其中核磁共振氢谱有六种不同化学环境的氢,且峰面积比为3∶2∶2∶1∶1∶1的是________________________(写结构简式)
①能发生银镜反应而且能发生水解
②能与FeCl3溶液发生显色反应
③只有一个甲基
(6)根据已有知识并结合题目所给相关信息,写出以![]() 和
和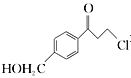 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:![]() _______________________
_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com