
在一个固定体积的密闭容器中,向容器中充入2 mol A 和1 mol B,发生如下反应:2A(g) + B(g)  3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L.
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L.
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应.
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是______(用序号填空).
①4 mol A+2 mol B ②3 mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mol D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于________L,小于________L.
(4分) (1)吸热(1分) (2)③(1分) (3)0.5 2.5(2分)
解析试题分析:(1)根据方程式可知,反应前后体积不变,但气体的质量减小。所以若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,这说明升高温度,平衡向正反应方向移动,即正方应是吸热反应。
(2)维持容器体积和温度不变,达到平衡时C的浓度仍为1.2mol/L,为等效平衡,且为完全等效平衡,按化学计量数转化到左边满足2molA和1molB即可,由2A(g)+B(g) 3C(g)+D(S)可知:
3C(g)+D(S)可知:
①4molA+2molB与初始A、B的物质的量不同,故①错误;
②3molC+lmolD+1molB换算成A、B,A、B物质的量分别为2mol、2mol,与初始A、B的物质的量不同,故②错误;
③3molC+2molD 换算成A、B,A、B物质的量分别为2mol、1mol,D为1mol,D是固体,对平衡无影响,故③正确;
④1.6mol A+0.8mol B+0.6molC换算成A、B,没有D,C不能反应,与初始A、B的物质的量不相同,故④错误,答案选③。
(3)若C未转化时,C的物质的量为3mol,此时体积最大,所以容器的体积V=3mol÷1.2mol/L=2.5L;若D完全反应时,平衡时C的物质的量最小,此时体积最小,根据方程式计算反应的C的物质的量:
2A(g)+B(g)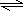 3C(g)+D(S)
3C(g)+D(S)
2.4mol 0.8mol
所以C的物质的量最小为3mol-2.4mol=0.6mol
所以容器的体积V=0.6mol÷1.2mol/L=0.5L
考点:考查可逆反应的有关判断和计算、等效平衡的应用
点评:该题是高考中的常见题型,属于中等难度试题的考查,侧重对学生分析、归纳和总结问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。采用极限反应法是解(3)题的关键,采用极限反应法求出C的物质的量,从而求出容器体积范围。


科目:高中化学 来源: 题型:填空题
(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题: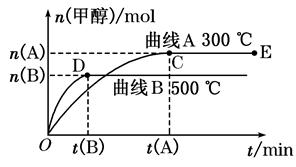
(1)反应达到平衡时,平衡常数表达式K=_________________,升高温度,K值___________(填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(选填选项字母)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
D.重新平衡时 增大 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。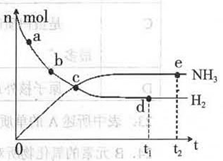
(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:___。
2NH3(g)的平衡常数值为:___。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:_____________。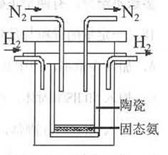
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为CrO42-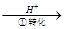 Cr2O72-
Cr2O72-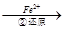 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42- (黄色)+2H+ Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为__________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_________________________________。溶液中同时生成的沉淀还有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知可逆反应CO+H2O(g)  CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K=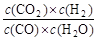 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(2)830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为 。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度时, 在一个0.5 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。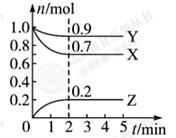
根据图中数据回答下列问题:
(1)该反应的化学方程式为 。
(2)反应开始至2 min,以气体Z表示的平均反应速率为 。
(3)用物质X表示的化学反应速率为0.2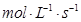 与用物质Y表示的化学反应速率为0.1
与用物质Y表示的化学反应速率为0.1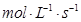 ,哪个快?( )
,哪个快?( )
a.前者 b.后者 c.一样快 d.无法比较
(4)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 (填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: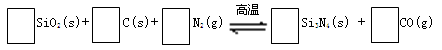
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是 ,其还原产物是 。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。
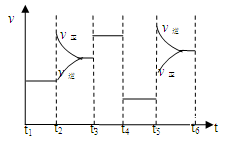
32.该反应的平衡常数表达式为K= 。升高温度,其平衡常数 (选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为 ,t5时引起v逆大变化、v正小变化的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图31-1所示: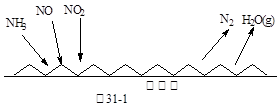
①由图31-1可知SCR技术中的氧化剂为: 。
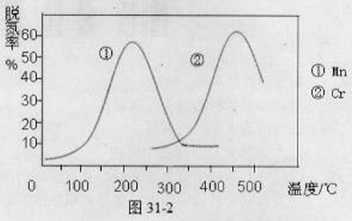
②图31-2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知最佳的催化剂和相应的温度分别为: 、 。
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图31-3所示,脱氮效果最佳的c(NO2)/c(NO)= 。已知生成1molN2反应放出的热量为QkJ,此时对应的脱氮反应的热化学方程式为 。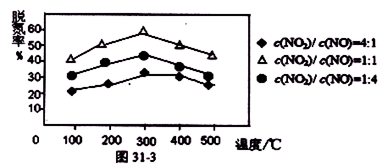
(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l) H2SO3(l)
H2SO3(l) H+(aq)+HSO3—(aq) I
H+(aq)+HSO3—(aq) I
HSO3—(aq) H+(aq)+SO32—(aq) II
H+(aq)+SO32—(aq) II
Ca(OH)2(s) Ca2+(aq)+2OH—(aq) III
Ca2+(aq)+2OH—(aq) III
Ca2+(aq)+SO32—(aq) CaSO3(s) IV
CaSO3(s) IV
④步骤II的平衡常数K的表达式为 。
⑤该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO32-的浓度。(写出计算过程,保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L-1·min-1,则以物质B表示此反应的化学反应速率为________mol·L-1·min-1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为________________。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)??2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有________mol A,此时C的物质的量浓度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com