
| A. | Br2在反应中表现氧化性 | B. | SO2在反应中被还原 | ||
| C. | Br2在反应中得电子 | D. | 1mol氧化剂在反应中得到1mol电子 |
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的实验式就是其分子式 | |
| B. | 质谱法可以测定物质的相对分子质量 | |
| C. | 从物质的红外光谱图可以获得分子中含有化学键或官能团的信息 | |
| D. | 从核磁共振氢谱图可以推知该有机物分子有几种不同类型的氢原子及他们的数目之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X | 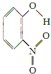 | 0.2 | 45 | 100 |
| Y | 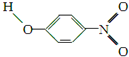 | 1.7 | 114 | 295 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片加入稀盐酸中:Cu+2H+=Cu2++H2↑ | |
| B. | 盐酸滴加在石灰石上:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-+Cu2++2 OH-=BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的水溶液能导电,所以SO2是电解质 | |
| B. | BaSO4难溶于水,其水溶液的导电能力极弱,所以BaSO4是弱电解质 | |
| C. | 液溴不导电,所以液溴是非电解质 | |
| D. | HI熔融状态不能导电,但HI是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度(mg/L) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度(mg/L) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 冶炼原理 | 方法 | |
| A | 2HgO$\frac{\underline{\;加热\;}}{\;}$2Hg+O2↑ | 热分解法 |
| B | 2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | 电解法 |
| C | Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | 热分解法 |
| D | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | 热还原法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com