
 ,它在元素周期表中的位置是第4周期ⅡA族,它的最高价氧化物对应水化物的化学式是Ca(OH)2.
,它在元素周期表中的位置是第4周期ⅡA族,它的最高价氧化物对应水化物的化学式是Ca(OH)2. 分析 元素符号左上角上的数字代表的是质量数,左下角上的数字代表的是质子数,中子数=质量数-质子数,根据原子的核内质子数=电子数的关系分析电子数;质子数为20,核外电子排布应该为2,8,8,2书写原子结构示意图;原子结构示意图中电子层数=周期数,最外层电子数=族序数判断所属的周期、族;最外层电子数等于最高正价,则该元素的最高价氧化物为CaO,CaO+H2O=Ca(OH)2,从而确定最高价氧化物对应水化物的化学式.
解答 解:4020Ca中左下角表示质子数,左上角表示质量数,中子数=质量数-质子数.所以其质子数为20,中子数为40-20=20,质量数为40;核外电子数=质子数,所以其电子数是20;其核外电子排布为2、8、8、2,该元素的原子结构示意图为 ,原子结构示意图中电子层数=周期数,最外层电子数=族序数,所以该元素是第4周期第ⅡA族;该元素的最高价氧化物为CaO,CaO+H2O=Ca(OH)2,
,原子结构示意图中电子层数=周期数,最外层电子数=族序数,所以该元素是第4周期第ⅡA族;该元素的最高价氧化物为CaO,CaO+H2O=Ca(OH)2,
所以其最高价氧化物的水化物化学式为Ca(OH)2.
故答案为:20;20;20; ;4;ⅡA;Ca(OH)2.
;4;ⅡA;Ca(OH)2.
点评 本题考查了质子数、中子数、质量数、电子数之间的相互关系,要注意在原子结构示意图中电子层数=周期数,最外层电子数=族序数确定在周期表中的位置.


科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2?2XY2 | B. | 2X2+Y2?X2Y | C. | 3X2+Y2?2X3Y | D. | X2+3Y2?2XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1molCu,转移2mol电子 | B. | Cu是氧化产物 | ||
| C. | Cu2S既是氧化剂又是还原剂 | D. | 氧化剂只有Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
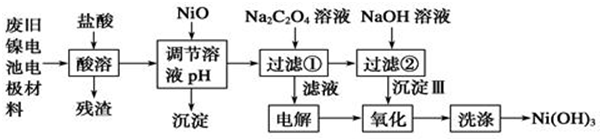
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
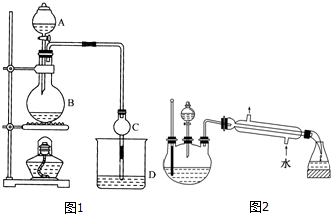
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| B. | 上述制氢气的化学方程式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$ 6nCO2↑+12nH2↑ | |
| C. | 氢元素的三种同素异形体${\;}_{1}^{1}H$、${\;}_{1}^{2}H$、${\;}_{1}^{3}H$,能形成六种单质 | |
| D. | 从化学的本质看该反应属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| B. | Fe(OH)3胶体无色、透明,能产生丁达尔现象 | |
| C. | H2、SO2、CO2三种气体都可用浓H2SO4干燥 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com