

分析 根据生成气体通过碱石灰体积不变(无酸性气体),而通过浓硫酸体积减小,说明剩余的3.36L气体为氢气,即原固体中一定含有金属Al,且其质量为:$\frac{3.36L}{22.4L/mol}$$\frac{2}{3}$×27 g/mol=2.7 g.生成氨气的物质的量为:$\frac{5.6L-3.36l}{22.4L/mol}$=0.1 mol,则原固体中一定含有 0.1 mol (NH4)2SO4,其质量为6.6g,得到白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明2.90g白色沉淀为Mg(OH)2,为0.05mol,则固体中MgCl2为0.05mol,质量为4.75g,无色溶液中有Al与过量NaOH溶液反应后得到的NaAlO2,以此解答该题.
解答 解:(1)白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),
故答案为:否;
(2)气体通过浓硫酸后,体积减少2.24L,说明气体中有NH3,则原固体中一定含有(NH4)2SO4,
故答案为:是;气体通过浓硫酸减少2.24L;
(3)应④是偏铝酸根与氢离子反应生成氢氧化铝沉淀,离子方程式AlO2-+H++H2O=Al(OH)3↓;
故答案为:AlO2-+H++H2O=Al(OH)3↓;
(4)由以上分析可知原固体中一定含有2.7g Al,原固体中一定含有 0.05 mol (NH4)2SO4,其质量为6.6g,固体中MgCl2为0.05mol,质量为4.75g,三种物质的质量之和刚好等于14.05g,所以一定没有AlCl3,
故答案为:是,存在的Al、(NH4)2SO4、MgCl2的 质量和小于14.05g,剩余固体一定是AlCl3.
点评 本题考查无机物的推断,题目难度中等,侧重于元素化合物知识的综合应用,为高考常考查题型,注意根据相关数据进行判断,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,水电离出的c(H+)=1×10-12 mol/L的溶液中不可能大量存在:Al3+、NH4+、Cl-、S2- | |
| B. | 加入铝粉能产生H2的溶液中可能大量存在:Na+、Cl-、S2-、SO32- | |
| C. | 过量铁粉与稀HNO3反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 向AlCl3溶液中滴入大量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
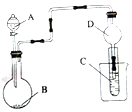
| A. | 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中产生白色沉淀,白色沉淀不会消失 | |
| B. | 实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| D. | 若A为浓盐酸,B为贝壳,C中盛有硅酸钠溶液,则C中出现白色沉淀可证明酸性的强弱为:碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的盐酸和氨水等体积混合,所得溶液的pH<7 | |
| B. | 物质的量浓度相等的硫酸和氨水等体积混合,所得溶液的pH<7 | |
| C. | pH=3的盐酸和pH=11的氨水等体积混合,所得溶液的pH>7 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合,所得溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液 | B. | NaOH溶液 | C. | 氨水 | D. | 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| M | N | ||
| X | Y | Z |
| A. | 氢化物的稳定性:N>Z,是因为其氢化物分子可形成氢键 | |
| B. | 元素的非金属性:M>Y,是因为单质M能与YN2反应生成单质Y | |
| C. | 熔沸点:YN2>MN2,是因为YN2的分子间作用力强 | |
| D. | 简单离子的半径:N>X,是因为它们具有相同的电子层结构且X的核电荷数更大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com