
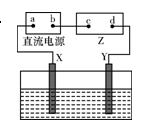
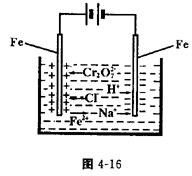
| A.接通电路后,水槽中溶液的pH不变 |
| B.b是正极,Y电极上发生氧化反应 |
| C.同温同压下,X、Y两电极上产生气体的体积相等 |
| D.d点显红色是因为接通电路后OH-向d点移动 |
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源:不详 题型:单选题
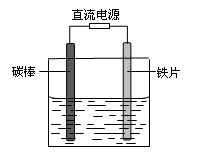
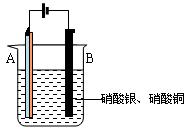
| A.碳棒接直流电源的负极 |
| B.碳棒上发生氧化反应 |
| C.铁片上的电极反应式为2Cl――2e-= Cl2↑ |
| D.铁片附近出现的浑浊物是Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.71:2 | B.71:216 | C.8:1 | D.16:137 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
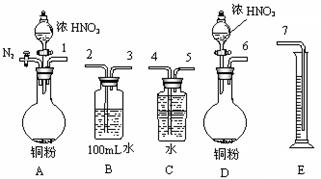
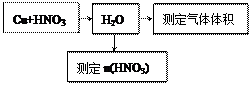 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
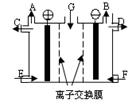
| A.气体A是H2 ,溶液E是稀硫酸 |
| B.气体B是H2 ,溶液D是NaOH溶液 |
| C.Na2SO4溶液由G处加入,F处加入稀硫酸[ |
| D.靠阳极室一侧的是阳离子交换膜,阴极室导出的是氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com