
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
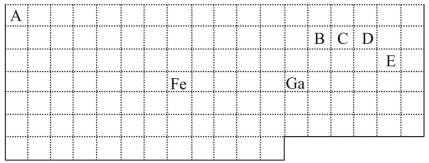
根据信息回答下列问题:
(1)周期表中基态Ga原子的电子排布式为___。
(2)Fe元素位于周期表的___分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为___。
(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为___和___(填化学式)。在CO、CH3OH中,碳原子采取sp3杂化的分子有___。
(4)根据VSEPR理论预测ED4-离子的空间构型为___。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有__(任写2种化学式)。
【答案】1s22s22p63s23p63d104s24p1 d 0 N2 CN- CH3OH 正四面体形 CO2、NCl3、CCl4、CO(任写2个)
【解析】
(1)主族元素的族序数=其最外层电子数=其价电子数,最外层电子在排列时,遵循能量最低原理;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的;Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,所以根据能量最低原理先排4s电子后排3d电子;Fe与CO易形成配合物Fe(CO)5,根据化合物的化合价代数和为0,所以Fe(CO)5的化合价代数和为0,CO是化合物,它的化合价的代数和是0,所以在Fe(CO)5中铁的化合价为 0;
(3)根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同就是等电子体,CO分子含两个原子,且组成该物质的元素一个是6号一个是8号,找它的等电子体时,如果是分子,就把两种元素的原子序数一个增大1一个减小1,如果是离子,其中一种元素不变,另一种原子序数增大(或减小),带正电荷(或负电荷);判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式,如:如果是直线型,采取的就是sp杂化;
(4)根据杂化轨道理论判断分子空间构型。
(1)31号元素Ga原子的电子排布式为1s22s22p63s23p63d104s24p1,故答案为:1s22s22p63s23p63d104s24p1;
(2)26号元素Fe元素在周期表的位于第四周期第Ⅷ族,位于周期表的d区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为0价,故答案为:d;0;
(3)与CO分子互为等电子体的分子是N2,离子为CN-;在CO、CH3OH中,碳原子采取sp3杂化的分子有CH3OH;CO中的C原子的杂化方式为sp杂化,故答案为:N2;CN-;CH3OH;
(4)根据表格中各种元素的相对位置可以看出:A是H;B是C;C是N;D是O;E是Cl,则ED4-离子ClO4-离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,σ键电子对数=σ键个数=中心原子结合的原子个数,中心原子是Cl原子,中心原子结合的原子个数是4,所以σ键电子对数=4,中心原子上的孤电子对数=1/2(a-xb),说明:x为配位原子个数,b为配位原子最多能接受的电子数,对于阴离子,a为中心原子的价电子数+离子所带的电荷数,中心原子上的孤电子对数=1/2(a-xb)=1/2(8-5×2)=0,所以价层电子对数=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型;在C、N、O、Cl原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有CO2、NCl3、CCl4、CO(任写2个),故答案为:正四面体形;CO2、NCl3、CCl4、CO(任写2个)。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康。
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用的流程如下图所示:
![]()
Na2S2O3在此过程中表现________性。若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为_________价,反应的离子方程式为______________________。
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车。其反应原理如下,请配平该反应方程式:
(_____)CrO3 +(_____)CH3CH2OH +(_____)H2SO4 —(_____)CH3CHO + (_____)Cr2(SO4)3+(_____)H2O
(3)已知存在平衡:2CrO42-+2H+![]() Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
已知Ksp(BaCrO4)=1.25×10-10;Ksp(PbCrO4)=2.75×10-13;
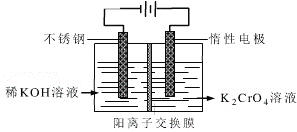
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图所示(阳离子交换膜只允许阳离子透过)。通电后阳极的电极反应式为____________________。请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示,下列有关叙述不正确的是
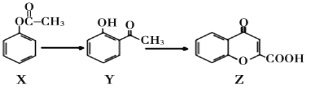
A. X的分子式为C8H8O2
B. X、Y、Z均能和NaOH溶液反应
C. 可用NaHCO3溶液鉴别Y和Z
D. 1mol X跟足量H2反应,最多消耗4mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如右图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
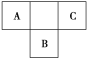
(1)A、B、C三种元素的名称分别为________、________、________。
(2)C的单质与H2反应的化学方程式为____________________________________。
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉的水解情况,某同学设计了以下三个实验方案,并根据实验现象,得出相应的结论:
甲:淀粉液![]() 水解液
水解液![]() 溶液变蓝 实验结论:淀粉未水解。
溶液变蓝 实验结论:淀粉未水解。
乙:淀粉液![]() 水解液
水解液![]() 无银镜现象 实验结论:淀粉未水解。
无银镜现象 实验结论:淀粉未水解。
丙:淀粉液![]() 水解液NaOH溶液,中和液
水解液NaOH溶液,中和液![]() 生成银镜 实验结论:淀粉完全水解。
生成银镜 实验结论:淀粉完全水解。
根据上述三个方案的操作及现象,首先回答结论是否正确,然后简要说明理由。如果三个结论均不正确,请另设计一个方案来证明淀粉已经水解完全了。
(1)方案甲:____________。
(2)方案乙:________。
(3)方案丙:___________。
(4)你的方案:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。
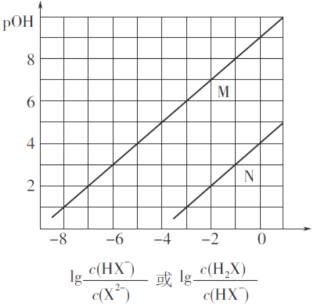
下列叙述正确的是
A. 曲线N表示pOH与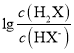 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃烧时的能量变化如图,有关说法正确的是( )

A.图1中反应为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=+890.3kJ/mol
B.图2中反应为:CH4(g)+![]() O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
C.由图可以推得:CO(g)+![]() O2(g)=CO2(g) H=﹣283kJ/mol
O2(g)=CO2(g) H=﹣283kJ/mol
D.由图可以推知:等物质的量的CO2和CO,CO2具有的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[ ]的变化如图所示:
]的变化如图所示:

①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com