

分析 淀粉在稀硫酸催化作用下水解为葡萄糖,加氢氧化钠溶液中和稀硫酸,为葡萄糖发生银镜反应提供碱性条件,加碘水溶液变蓝,说明淀粉水解不完全,加银氨溶液加热,葡萄糖被银氨溶液氧化,可生成Ag,据此分析.
解答 解:淀粉在稀硫酸催化作用下水解为葡萄糖,故A为稀硫酸;加氢氧化钠溶液中和稀硫酸,为葡萄糖发生银镜反应提供碱性条件,加碘水溶液变蓝,说明淀粉水解不完全,加银氨溶液加热,葡萄糖被银氨溶液氧化,可生成Ag,故C为银氨溶液.
(1)A为稀硫酸,C为银氨溶液,故答案为:稀硫酸;银氨溶液;
(2)由于淀粉的水解液显酸性,而银镜反应要求的环境为碱性,故应加入NaOH中和硫酸,然后加入银氨溶液,加热从而得到单质银,此反应称为银镜反应,故答案为:银镜反应;
(3)淀粉水解完全后,加入单质碘,不会变蓝,故方法为:取反应液少量,滴入碘水,无变蓝现象,说明此淀粉液已经水解完全,无淀粉存在.故答案为:取反应液少量,滴入碘水,无变蓝现象,说明此淀粉液已经水解完全,无淀粉存在.
点评 本题考查了淀粉、葡萄糖的性质,难度不大,明确葡萄糖发生银镜反应的条件是解题的关键,注意淀粉、葡萄糖特性的掌握.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0℃,1.01×105Pa时,22.4L空气中所含的N2、O2分子总数为5NA | |
| B. | 100mL 0.1mol/L的硝酸钙溶液中钙离子的数目为0.02NA | |
| C. | 6.5g Zn由原子变为离子时失去的电子数目为0.2NA | |
| D. | 0.012kg的${\;}_{6}^{14}$C中的碳原子数目等于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
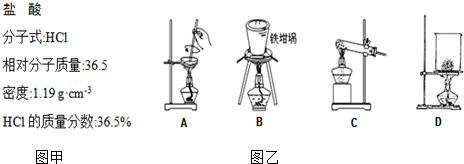
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
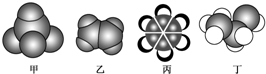
| A. | 甲不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙可与溴的四氯化碳溶液发生加成反应而使溴的四氯化碳溶液褪色 | |
| C. | 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com