
| A. | Na+、Fe3+、SO42-、NO3- | B. | Na+、K+、Br -、AlO2- | ||
| C. | Na+、NO3-、Cl-、SO42- | D. | Na+、K+、I-、NO3- |
科目:高中化学 来源: 题型:选择题
| A. | Ca2(PO4)3(OH) | B. | Ca5(PO4)3(OH) | C. | Ca4(PO4)3(OH) | D. | Ca3(PO4)3(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | Ⅱ |
| B | 47 | 29 | 35 | SO2 | Ⅰ |
| C | 62 | 80 | 113 | PM10 | Ⅲ |
| D | 52 | 76 | 59 | NO2 | Ⅰ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、K--遇湿易燃物品 | B. | TNT、NH4NO3--爆炸品 | ||
| C. | CH4、C2H5OH--易燃气体 | D. | 浓H2SO4、浓HNO3--腐蚀品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液鉴别乙烯和乙醇 | |
| B. | 将乙烷与溴水混合光照制溴乙烷 | |
| C. | 苯和硝基苯的混合物采用分液的方法分离 | |
| D. | 可用CCl4萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
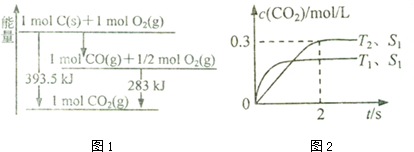
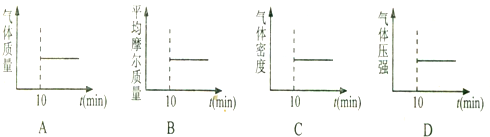
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com