
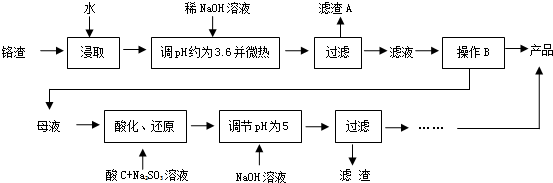
分析 铬渣含有Na2SO4及少量Cr2O72-、Fe3+,加入氢氧化钠调节pH约3.6并加热,可生成Fe(OH)3沉淀,过滤得到A为Fe(OH)3,由于Na2Cr2O7溶解度在温度较高时较大,滤液经蒸发浓缩,趁热过滤得到硫酸钠,母液中含有Na2Cr2O7,加入亚硫酸钠,发生氧化还原反应可得到Cr3+,调节溶液pH为5,可生成沉淀D,即Cr(OH)3,以此解答该题.
解答 解:铬渣含有Na2SO4及少量Cr2O72-、Fe3+,加入氢氧化钠调节pH约3.6并加热,可生成Fe(OH)3沉淀,过滤得到A为Fe(OH)3,由于Na2Cr2O7溶解度在温度较高时较大,滤液经蒸发浓缩,趁热过滤得到硫酸钠,母液中含有Na2Cr2O7,加入亚硫酸钠,发生氧化还原反应可得到Cr3+,调节溶液pH为5,可生成沉淀D,即Cr(OH)3,
(1)加热可以提高反应速率,且有利于Fe3+水解生成Fe(OH)3而除去,
故答案为:提高反应速率;促进Fe3+水解生成Fe(OH)3而除去;
(2)由于Na2Cr2O7溶解度在温度较高时较大,滤液经蒸发浓缩,趁热过滤得到硫酸钠,故答案为:a;
(3)酸化后的Cr2O72-可被SO32-还原成Cr3+,离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O,Na2Cr2O7具有强氧化性,酸化时,一般用稀硫酸,Cr3+完全沉淀(c≤1.0×10-5 mol•L-1)时pH5,则c(OH-)=1.0×10-9 mol•L-1,Ksp[Cr(OH)3]=c3(OH-)×c(Cr3+)=1.0×10-32 mol4•L-4,
故答案为:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;H2SO4; 1.0×10-32 mol4•L-4;
(4)如果氢氧化钠过量,氢离子浓度减少平衡H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-,平衡逆向移动,Cr(OH)3会溶解,
故答案为:加入NaOH使上述平衡逆移,使Cr(OH)3+OH-=CrO2-+2H2O;
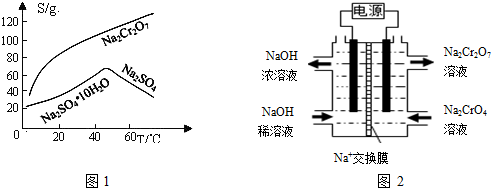
(5)根据2CrO42-+2H+=Cr2O72-+H2O电解Na2CrO4溶液制取Na2Cr2O7,应在酸性条件下进行,即右侧电极生成H+,则消耗OH-,发生氧化反应,右侧为阳极,则左侧为阴极,连接电源的负极,电解制备过程的总反应方程式为 4Na2CrO4+4H2$\frac{\underline{\;通电\;}}{\;}$O 2Na2Cr2O7+4NaOH+2H2↑+O2↑,设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为$\frac{x}{2}$mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,解得x=2-d,转化率为$\frac{2-d}{1}$×100%=(2-d)×100%,
若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O,
故答案为:负; 4Na2CrO4+4H2O $\frac{\underline{\;通电\;}}{\;}$2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2-d)×100%;CH3OH-6e-+3CO32-=4CO2+2H2O.
点评 本题考查物质的分离、提纯的实验设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目以实验形式考查电解原理及难溶电解质的溶解平衡和沉淀转化,注意信息与所学知识的结合来解答,并注意氧化还原反应及图表数据的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤ | C. | ②③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙醇是一种常用的燃料,也可用于燃料电池.该燃料电池的工作原理如图所示.
乙醇是一种常用的燃料,也可用于燃料电池.该燃料电池的工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
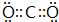 ;C 单质在高温下与B单质充分反应所得化合物的电子式为
;C 单质在高温下与B单质充分反应所得化合物的电子式为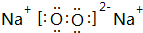 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
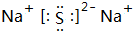 ,D原子的质子数和中子数相等,D的原子组成符号为1632 S.
,D原子的质子数和中子数相等,D的原子组成符号为1632 S.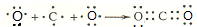 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
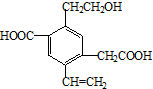
| A. | 该物质在Cu或Ag催化作用下加热,能够被氧化为相应的醛 | |
| B. | 可以用酸性高锰酸钾溶液检验,紫红色褪去,证明其含有碳碳双键 | |
| C. | 1mol该有机物,一定条件下最多可以和4molH2加成 | |
| D. | 该物质消耗Na、NaHCO3、Cu(OH)2的物质的量之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.12天津爆炸事件后,为处理现场散落的剧毒物NaCN,应喷洒双氧水 | |
| B. | 明矾和高铁酸盐都可用于饮用水的处理,因为它们均能杀菌消毒 | |
| C. | 向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染 | |
| D. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4根据化合价规律可表示为FeO•Fe2O3,则Pb3O4也可表示为PbO•Pb2O3 | |
| B. | CaC2能水解:CaC2+2H2O=Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O=4A1(OH)3↓+3CH4↑ | |
| C. | Cl2与Fe加热生成FeCl3,则I2与Fe加热生成FeI3 | |
| D. | SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com