

分析 (1)电解饱和食盐水时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子,根据电极反应式解答该题;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,则粗铜是阳极,精铜是阴极,根据电解池的工作原理来书写电极反应式并判断离子的浓度大小变化;
(3)铁上镀锌,则镀件是阴极,镀层金属是阳极,根据电解池的工作原理知识来回答.
解答 解:(1)①若X、Y都是惰性电极,a是饱和NaCl溶液,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,故答案为:2H++2e-=H2↑;溶液变红,有气泡产生;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气可用淀粉碘化钾试纸检验,可使试纸变蓝色,
故答案为:2Cl--2e-=Cl2↑; 用湿润的淀粉碘化钾试纸检验,看是否变蓝;
(2)①电解方法精炼粗铜,电解池的X电极是阴极,材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,电解池的Y电极是阳极,材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+;
③电解方法精炼粗铜,阴极是Cu2++2e-=Cu,阳极上先是金属锌、铁、镍等金属失电子,然后是铜失电子生成铜离子的过程,所以电解后,铜离子浓度是减小的,故答案为:减小;
(3)如利用该装置实现铁上镀锌,镀件铁是阴极,镀层金属锌是阳极,电极X极即阴极上发生的反应为:Zn2++2e-=Zn,电镀液是含有镀层金属阳离子
的盐溶液,可以是ZnCl2溶液或是ZnSO4溶液.
故答案为:ZnCl2溶液;ZnSO4溶液.
点评 本题考查原电池原理,为高频考点,侧重于学生的分析能力的考查,本题涉及电极反应式的书写、检验等知识点,知道离子放电顺序及电极反应式的书写方法,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了“焰色反应”这一化学反应放出的能量 | |
| B. | 食盐中因为含有少量CaCl2、MgCl2晶体易潮解,它们潮解的实质是晶体表面吸水形成溶液 | |
| C. | 2013年11月,中科院国家纳米科学中心首次“拍”到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO是一种红棕色的气体 | |
| B. | 常温常压下NO不能与空气中的氧气直接化合 | |
| C. | 含等质量的氧元素的NO和CO的物质的量相等 | |
| D. | NO易溶于水,不能用排水法收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
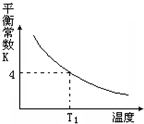 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A. | 前5min用Z表示的平均反应速率为0.2 mol/(L•min) | |
| B. | 该反应的正反应是吸热反应,且T1>T | |
| C. | 若温度为T1时,以同样的起始量反应,达到平衡时X的转化率约为66.7% | |
| D. | 在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的转化率仍为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的( )
室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的( )| A. | I曲线表示的是滴定盐酸的曲线 | |
| B. | x=20 | |
| C. | 滴定过程中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值逐渐减小 | |
| D. | 当I曲线和II曲线pH均为7时,一溶液中的c(Cl-)等于另一溶液中的c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
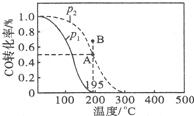 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲苯含C-H键的数目为6NA | |
| B. | 反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中生成28gN2时,转移电子数目为15NA | |
| C. | 1molFeCl3与水反应完全转化为氢氧化铁胶体后,胶体粒子的数目为NA | |
| D. | 含有4.6g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
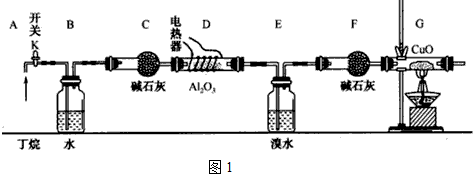
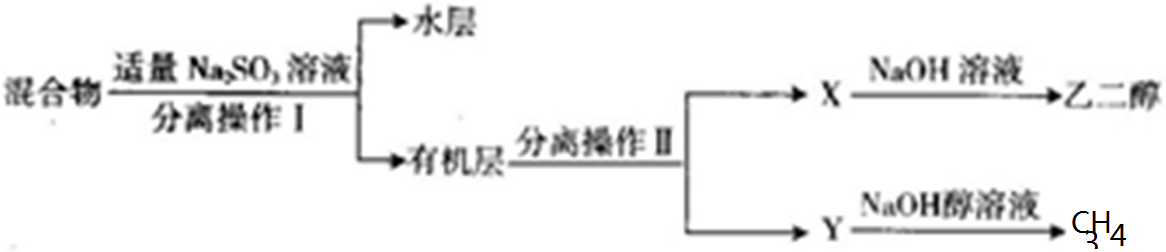
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com