
| A�� | ��Na2CO3��Һ�У�c��OH-��-c��H+���Tc��HCO3-��+c��H2CO3�� | |
| B�� | ��pH=8��NaB��Һ�У�c��Na+��-c��B-��=9.9��10-7 mol/L | |
| C�� | Ũ�Ⱦ�Ϊ0.1 mol/L��NaClO��NaHCO3�����Һ�У�c��HClO��+c��ClO-���Tc��HCO3-��+c��H2CO3�� | |
| D�� | ��10mL pH=12��NaOH��Һ�еμ�pH=2��HA��Һ�����ԣ�����Һ���V�ܡ�20mL |
���� A������̼������Һ�е������غ�����жϣ�
B��pH=8����c��H+��=1��10-8 mol/L��c��OH-��=1��10-6 mol/L��Ȼ����ݵ���غ���м��㣻
C�����ݴ������ơ�̼�����Ƶ������غ��жϣ�
D���ֱ����HAΪǿ�������������ۣ�
��� �⣺A���κε������Һ�ж����������غ㣬���������غ�ã�c��OH-��=c��H+��+c��HCO3-��+2c��H2CO3������c��OH-��-c��H+��=c��HCO3-��+2c��H2CO3������A����
B��pH=8��NaB��Һ�У�c��H+��=1��10-8 mol/L��c��OH-��=1��10-6 mol/L�����ݵ���غ�ɵã�c��Na+��-c��B-��=c��OH-��-c��H+��=9.9��10-7 mol/L����B��ȷ��
C��Ũ�Ⱦ�Ϊ0.1 mol/L��NaClO��NaHCO3�����Һ�У����������غ�ɵã�c��HClO��+c��ClO-��=c��Na+��=c��HCO3-��+c��H2CO3��+c��CO32-������C����
D����10mL pH=12��NaOH��Һ�еμ�pH=2��HA��Һ�����ԣ���HAΪ����ʱ������10mLHA��Һʱǡ��Ϊ���ԣ�����Һ���V��=20mL����HAΪ���ᣬ��HA��Ũ�ȴ���NaOH����ҺΪ����ʱ�����HA��Һ���С��10mL������Һ���V�ܣ�20mL�����Ի��Һ���V�ܡ�20mL����D����
��ѡB��
���� ���⿼��������Ũ�ȴ�С�Ƚϣ���Ŀ�Ѷ��еȣ���ȷ����غ㡢�����غ㡢�����غ㼰�ε�ˮ��ԭ��Ϊ���ؼ���DΪ�״��㣬��Ҫ��ȷHAΪ����ʱ��Ũ�ȴ����������ƣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHB�ĵ��뷽��ʽΪ��NaHB?Na-+H-+B2- | |
| B�� | NaHB��Һһ�������� | |
| C�� | NaHB��NaOH��Һ��Ӧ�����ӷ���ʽΪH++OH-�TH20 | |
| D�� | NaHB��Һ��һ�����ڣ�c��Na+��+c��H+���Tc��HB-��+2c��B2-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D | |
| �������� | ʯī��ʯī | ZnƬ��CuƬ | ZnƬ��CuƬ | ʯī��CuƬ |
| ������Һ | H2SO4��Һ | �Ҵ���Һ | ϡ���� | H2SO4��Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����пƬ�ʹ�ͭƬ����ͼ��ʽ����100mL��ͬŨ�ȵ�ϡ������һ��ʱ�䣬�ش��������⣺
����пƬ�ʹ�ͭƬ����ͼ��ʽ����100mL��ͬŨ�ȵ�ϡ������һ��ʱ�䣬�ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
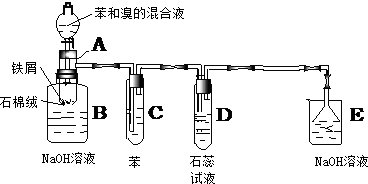

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
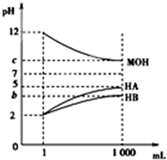 �����£���pH=2����������ҺHA��HB��pH=12�ļ���ҺMOH��1mL���ֱ��ˮϡ�͵�1 000mL����pH�ı仯����Һ����Ĺ�ϵ��ͼ������˵��������ǣ�������
�����£���pH=2����������ҺHA��HB��pH=12�ļ���ҺMOH��1mL���ֱ��ˮϡ�͵�1 000mL����pH�ı仯����Һ����Ĺ�ϵ��ͼ������˵��������ǣ�������| A�� | HAΪǿ�ᣬHBΪ���� | |
| B�� | ��b+c=14����MOH���� | |
| C�� | ��c=9����ϡ�ͺ��������Һ�У���ˮ����������ӵ�Ũ�ȵĴ�С˳��ΪHA��MOH��HB | |
| D�� | ��c=9����ϡ�ͺ��HA��Һ��MOH��Һȡ�������ϣ���������Һ��c��A-��=c��M+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��������ˮ�е��ܽ�ȴ� | |
| B�� | �����ʵ�ˮ��Һ��������ǿ | |
| C�� | �����ʵ�ˮ��Һ�в��������ʷ��� | |
| D�� | �����ʵ�ˮ��Һ�в����ڳ�ˮ��ĵ���ƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH��CH2CH3��CH2CH3 2-�һ����� | B�� | CH2CHBr2 �������� | ||
| C�� | CH3CH��CH3��CH=CH2 2-����ϩ | D�� | 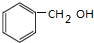 ���״� ���״� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | 1���ҷ����к���3��Aԭ�� | B�� | �÷�Ӧ�����ǷֽⷴӦ | ||
| C�� | ��Ӧ���ɵı��������ڵ��� | D�� | ��ѧ��Ӧ�з��ӵ�������˸ı� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com