

分析 (1)原子核内有10个质子的原子为氖原子;核外有10个电子的二价阳离子,其核内质子数为10+2=12,所以为镁离子;核外有18个电子的一价阴离子,该元素的核电荷数为18-1=17,为氯离子;
(2)由原子(或离子)结构简图可知A、B、C、D分别为Na、C、S2-、F;
电子层越多,半径越大;电子层数相同,原子序数越小,半径越大;
由元素的化合价可知,微粒中元素的化合价处于最低价具有还原性,处于最高价具有氧化性,处于中间价态时既有氧化性又有还原性;
最外层电子数为4时,既不容易得到电子,也不容易失去电子;
解答 解:(1)原子核内有10个质子的原子为氖原子(Ne);
核外有10个电子的二价阳离子,则其核电荷数为:10+2=12,该阳离子为镁离子(Mg2+);
核外有18个电子的一价阴离子,其核电荷数=18-1=17,该粒子为氯离子(Cl-);
故答案为:Ne;Mg2+;Cl-;
(2)由原子(或离子)结构简图可知A、B、C、D分别为:Na、C、S2-、F;
电子层越多,半径越大;电子层数相同,原子序数越小,半径越大,所以原子半径最小的是F;
F为元素的最低价,只具有氧化性,S2-、Na为元素的最低价,只具有还原性,C为元素的中间价态,既有氧化性又有还原性;
碳原子最外层电子数为4,既不容易得到电子,也不容易失去电子;
故答案为:F;S2-、Na;F;C.
点评 本题考查原子或离子结构、氧化还原反应,注意元素的价态及元素性质的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 宇宙星体、地球内部都处于高压状态,探究“高压下钠和锂单质金属→绝缘体转变”现象的本质、理解处于高压状态下一些物质的行为具有重要意义,它们可以为研究星体和地球内部构造提供理论支持 | |
| B. | 工业、农业以及日常生活中产生的污水应当分开处理.常用的污水处理方法有中和法、氧化还原法、离子交换法、萃取法、吹脱法、吸附法、电渗析法等,其中前三种属于化学处理方法 | |
| C. | 新型炸药--C4塑胶炸药得名于其空间网状延展结构的每个结构基元含有4个碳原子,由于该炸药成体时无需包裹金属外壳及添加金属芯件,因此能轻易躲过普通X光安全检查,具有较强的隐蔽性 | |
| D. | 建筑领域常使用的黏土、石英、白垩石和多用于农业和食品工业的硅藻土、硅胶均不属于硅酸盐材料的范畴 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有反应:A.CaCO3═CaO+CO2
现有反应:A.CaCO3═CaO+CO2 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
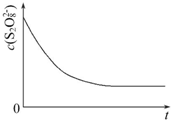 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | FeCl3 | C. | FeCl2 | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验药品 | 实验器材(省略加持装置) | |
| A | 制备氧气 | 双氧水、二氧化锰 | 分液漏斗、烧瓶、酒精灯、导管 |
| B | 除去CO2中的HCl气体 | 饱和Na2CO3溶液 | 洗气瓶、导管 |
| C | 配制0.5mol/L、230mL的稀硫酸溶液 | 用98%、1.84g/mL的浓硫酸6.8ml | 10mL量筒、烧杯、玻璃棒、胶头滴管、250容量瓶 |
| D | 检验碳与浓硫酸加热产生的气体中是否含有CO2 | 澄清石灰水 | 烧杯、导管 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com