
下列实验过程和过程中涉及的离子反应方程式肯定正确的是
A.除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2+ + Cl2 2Fe3+ + 2Cl-
2Fe3+ + 2Cl-
B.检验丙烯醛CH2=CHCHO中含有碳碳双键:CH2=CHCHO + Br2 CH2Br-CHBr-CHO
CH2Br-CHBr-CHO
C.向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2+ + 2OH-+ NH4+ + H+ + SO42- BaSO4↓ + NH3·H2O + H2O
BaSO4↓ + NH3·H2O + H2O
D.向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2 + 4Fe2+ + 6H2O 4Fe(OH)3 ↓+ 8Na+ + O2↑
4Fe(OH)3 ↓+ 8Na+ + O2↑
D
【解析】
试题分析:A.向硫酸铜溶液中通入氯气,会发生反应: 2Fe2+ + Cl2==2Fe3+ + 2Cl-,但是会引入新的杂质离子Cl-,因此不能用氯气除去杂质硫酸亚铁,错误;B.碳碳双键和醛基都可以与溴水发生反应,因此不能用溴水检验检验丙烯醛CH2=CHCHO中含有碳碳双键,错误;C.向Ba(OH)2溶液中加入过量的NH4HSO4溶液,应该以Ba(OH)2溶液为标准,离子方程式是: Ba2+ + 2OH-+ 2H+ + SO42-==BaSO4↓ + 2 H2O,错误;D.n(Na2O2)= 7.8 g÷78g/mol=0.1mol。向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2,符合物质的原子守恒及电子守恒,离子方程式4Na2O2 + 4Fe2+ + 6H2O==4Fe(OH)3 ↓+ 8Na+ + O2↑正确。
考点:考查反应事实及离子方程式的正误判断的知识。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
下列A-D各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
甲 | 乙 | 丙 | |
A | Al2O3 | HNO3 | Ba(OH)2 |
B | NH3 | O2 | H2SO4 |
C | SiO2 | NaOH | HF |
D | CO2 | Na2O2 | H2O |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0
C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀
D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g) + xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |

下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L·min)
B.由图可知:T1<T2,且该反应为放热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:选择题
下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
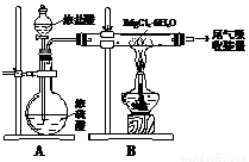
A.装置A中圆底烧瓶中可以换成固体MnO2
B.如果直接加热MgCl2?6H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO
C.尾气吸收可以用浓硫酸作为吸收剂进行吸收
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三第一学期期末考试化学试卷(解析版) 题型:填空题
(16分)某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果。
已知:C(s)+O2(g)  CO2(g) △H=-393kJ?mol-1 ;
CO2(g) △H=-393kJ?mol-1 ;
2CO (g)+O2(g)  2CO2(g) △H=-566kJ?mol-1;
2CO2(g) △H=-566kJ?mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为 。
(2))将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
H2O | CO | CO2 | |||
1 | 500 | 4 | 8 | 3.2 | 4 |
2 | 750 | 2 | 4 | 0.8 | 3 |
3 | 750 | 2 | 4 | 0.8 | 1 |
①该反应的正反应为 (填“吸热”或“放热”)反应。
②实验1中,0~4min时段内,以v(H2)表示的反应速率 为 。
③实验2达到平衡时CO的转化率为 。
④实验3与实验2相比,改变的条件是 ;
请在下图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注。

(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。
2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三第一学期期末考试化学试卷(解析版) 题型:选择题
下列各离子组能够大量共存的是
A.H+ 、NH4+、I-、NO3— B.Na+、 Ca2+、 ClO-、HCO3—
C.K+、Mg2+、CO32—、SO42— D.Hg2+、H+、Cl-、S2-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三学业水平考试理综化学试卷(解析版) 题型:填空题
(16分)碳氧化物的转化有重大用途,回答关于CO和CO2的问题。
(1)己知:① C (s) + H2O(g)  CO (g) +H2 (g) △H1
CO (g) +H2 (g) △H1
② 2CO(g) + O2(g) = 2CO2 (g) △H2
③H2O (g)= H2 (g) +1/2 O2 (g) △H3
则C (s) + O2 (g) =CO2 (g)的△H = (用△H1、△H2、△H3表示)。
(2)对于化学平衡①,在不同温度下,CO的浓度与反应时间的关系如图所示,
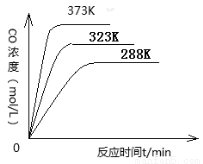
由图可得出如下规律:随着温度升高,① ;② 。
(3)某温度下,将6.0 mol H2O(g)和足量碳充入3 L的恒容密闭容器中,发生如下反应: C (s) + H2O(g) CO (g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
CO (g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
(4)在神州九号飞船中,宇航员呼出的CO2也可以采用Na2O2吸收,写出相关的化学方程式并标明电子转移的方向和数目: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015天津市和平区高一上学期期末考试化学试卷(解析版) 题型:填空题
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。
(1)硝酸在该反应中的作用是__________________。该反应的还原产物是________________
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com