
����Ŀ��������������ҡ������ˮ�����DZ����ˮ��Դ�������̲��ŷḻ�Ļ�ѧ��Դ��
��1����ҵ�Ͻ��к�ˮ�����ж��ַ�����
����������ʷ��ã��������ձȽϳ���ĺ�ˮ������������ͼ�Ǻ�ˮ����װ��ʾ��ͼ������B��������_________��

����ͼ��Ĥ���뼼�����к�ˮ������ԭ��ʾ��ͼ��ˮ���ӿ���������Ĥ������ˮ�������������Ӳ���ͨ������Ĥ����ѹ���Ҳຣˮ�м��ٵ���_______������ţ���

a. �������� b. ��Һ���� c. �ܼ����� d. ���ʵ����ʵ���Ũ��
��2�����ں�ˮ����Ҫ��I������ʽ���ڣ����ڵؿ�����Ҫ��IO3������ʽ���ڣ���������֮���ת����ϵ����ͼ����

�ٺ�ˮΪԭ�ϰ�����i��ȡI2�����ӷ���ʽ��___________________����֪I2������Cl2������Ӧ����IO3-���ɸ÷���ȡI2ʱӦע����Ƶķ�Ӧ������_______��
���Է���ii����Һ����ȡI2����Ӧ�����ӷ���ʽ�ǣ���֪����Ӧ��������Һ�����ԣ�________��
����ͼiii�з�Ӧ����Һ��IO3����Cl���ĸ�����Ϊ1��6����÷�Ӧ���������ͻ�ԭ�������ʵ���֮����__________��
���𰸡� ������ bc Cl2+2I-=2Cl-+I2 �������ܹ��� 2IO3-+5HSO3-=5SO42-+H2O+3H++ I2 3:1
��������
(1)����ȴˮ�Ľ���������������Ч����,������������������;������Ĥ��������ˮ����ͨ�����������Ӳ���ͨ��,���Ժ�ˮ���ܼ��������١����ʵ�������;(2)����������ǿ������,�ܽ�����������Ϊ��,��������ԭΪ������,�������˻������ⵥ��Ϊ���������;������������, IO3-��HSO3-����������ԭ��Ӧ����SO42-��H+��I2������������ClԪ�ػ��ϼ���0�۱�Ϊ-1�ۡ���ԭ����I-Ԫ�ػ��ϼ���-1�۱�Ϊ+5��,����ת�Ƶ��������ƽ����ʽ,�Ӷ�ȷ���������ͻ�ԭ�������ʵ���֮����
(1)��B��ȴװ�ã�ˮ�Ľ����������µ��ϡ���ͼ֪��������������������������ȷ����:��������
������Ĥ��������ˮ����ͨ�����������Ӳ���ͨ��,���Ժ�ˮ���ܼ��������١����ʵ�������,��ˮ��������,��ѡbc��������ȷ����:bc��
(2)����������ǿ������,�ܽ�����������Ϊ��,��������ԭΪ������,���ӷ���ʽΪCl2+2I-=2Cl-+I2,����ͼ����֪��,�÷���ȡI2ʱӦע����Ƶķ�Ӧ�������������ܹ�����������ȷ����Cl2+2I-=2Cl-+I2��Cl2������(������)��
������������,IO3-��HSO3-����������ԭ��Ӧ����SO42-��H+��I2,���ӷ�Ӧ����ʽΪ2IO3-+5HSO3-=5SO42-+H2O+3H++ I2,������ȷ����: 2IO3-+5HSO3-=5SO42-+H2O+3H++ I2��
����ͼiii��I�����IO3��ת��6e-���ڻ�ԭ����Cl2��ΪCl-ת��2e-����Ӧ����Һ��IO3����Cl-�ĸ�����Ϊ1��6��3Cl2+I-+3H2O=6Cl-+ IO3-+6 H+����Ӧ���������ͻ�ԭ�������ʵ���֮����3:1����ˣ�������ȷ����: 3:1��


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Լ���ơ������Լ��������л�±���������þ����ˮ���ѻ������(THF)�з�Ӧ�Ƶã����л��ϳ�����;�㷺����Ӧԭ�����£�
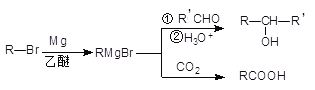
��A( ![]() )�ϳ� I (
)�ϳ� I ( ![]() )������ͼ��
)������ͼ��
����֪��NBSΪ�廯�Լ�����һ������������ϩ�������������ϩ������
(1) ����A������Ϊ_________________����A����B�ķ�Ӧ������_________��
(2) д����A�Ʊ� ![]() �Ļ�ѧ����ʽ_________________________��
�Ļ�ѧ����ʽ_________________________��
(3) �������һ���������ܼ��������( ![]() )����õ���������Ľṹ��ʽΪ_____________________��
)����õ���������Ľṹ��ʽΪ_____________________��
(4) д����G����H�Ļ�ѧ����ʽ_____________________________________��
(5) д����������Ҫ���I��ͬ���칹��Ľṹ��ʽ_____________________��(д��һ�ּ��ɣ�ͬһ̼�ϲ�������2���ǻ�)
�� �����廯���� �� ��Ԫ�� �� ��������5�ֻ�ѧ������H
(6) ����������Ϣ����A��A�ƵõĻ���ͪ( ![]() )Ϊԭ�Ϻϳ�
)Ϊԭ�Ϻϳ�![]() ��
��![]() ��______________________��
��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϸ���г����Ļ�ѧԪ����20���֣����и���Ԫ���У�ȫ����Ԫ�ص���
A.Fe��Mn��Mo��S ��BB.Mo��Zn��Cu��B.��Fe
C.P��N��K��Ca��MgD.C��H��O��Ca��Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�����ӷ���ʽ�У���ȷ���ǣ�
A. ����ı�ȼ����Ϊ890.3 kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H="-890.3" kJ/mol
B. CO(g)��ȼ������283.0 kJ/mol ����2CO2(g)=2CO(g)+O2(g)�ķ�Ӧ����H="+2��283.0" kJ/mol
C. NaOH��HCl��Ӧ���к��� ��H=-57.3kJ/mol����H2SO4��Ca(OH)2��Ӧ���к�����H=2��(-57.3)kJ/mol
D. 500����30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H=-38.6kJ/mol
2NH3(g) ��H=-38.6kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ����ѧ����ϳ�һ�֡����ع��족�����η��ӣ����ѡ������Ρ���C60�۽��������Ρ���Si60�����У�����Ĺ�ԭ���������̼ԭ���Թ��ۼ���ϡ����й������ַ��ӵ�˵���в���ȷ����(����)
A. ��һ�����ͻ����� B. �������ڷ��Ӿ���
C. �����ֵ�����ɵĻ���� D. ��Է�������Ϊ2400
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ,��0.1mo/L��NaOH��Һ����ʢ��50mL pH= 2��H A��Һ�ľ���������,����NaOH��Һ�����V����Һ�¶�T�Ĺ�ϵ����ͼ������˵����ȷ����
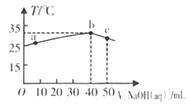
A. a����Һ��,c(A-)+ c(HA)= 0.08mol/L.
B. b����Һ��,c(A-)��c(Na+))
C. b �� c�Ĺ����У����������ȷ�Ӧ
D. ��Һ��HA�ĵ���ƽ�ⳣ��a�����b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.Ԫ�����ڱ��У��ڢ�A��Ԫ�غ͵ڢ�A��Ԫ�ص�ԭ��֮��ֻ���γ����Ӽ�
B.���л�ѧ�����ڲ������ڻ�ѧ��
C.CO2��SiO2�������������ܴ�������ͬ���͵Ļ�ѧ��
D.HF�����ȶ��Ժܺã�����ΪHF���Ӽ�����Ž�ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨNaCl��Na2CO3��10H2O��NaHCO3�Ļ�����и���ֵĺ�����ijͬѧ�������ʵ����ȡһ�������Ļ���ͨ��������Ӧǰ��������װ�������ı仯���ⶨ�û�����и���ֵ���������������˵���������

A. �����������п�������ʢװ��ʯ�ҡ���ˮCaCl2����ʯ��
B. Ӳ�ʲ����ܼ���ǰ��Ӧ�ر�b����a������ͨ�������ֱ��a �������Ŀ�������ʹ����ʯ��ˮ�����Ϊֹ
C. ������װ�û���ʢ��NaOH��Һ��ϴ��ƿ�����õ�NaCl����ƫ��
D. ʵ�������һֱͨ�������ֹͣ���Ⱥ���ֹͣͨ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ�ã�C��D��E��F��X��Y���Ƕ��Ե缫������Դ��ͨ����(��)�е����̪��Һ����F�������Ժ�ɫ��������˵����ȷ���� ( )
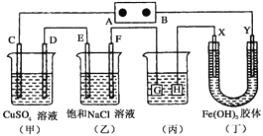
A. ��ԴB��������
B. (��)(��)װ�õ�C��D��E��F�缫���е������ɣ������ʵ�����Ϊ1:2:2:2
C. ����(��)װ�ø�ͭ������HӦ����Ag�����Һ��AgNO3��Һ
D. װ��(��)��Y���������ɫ��dz��˵���������������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com