
 A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
 .
.分析 A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,由元素再周期表中位置,可知A为H元素;B为碳元素,C为N元素;D为O元素;E为Na,F为Al;G为Si;H为S元素.
(1)由E的位置可知,处于周期表中第三周期第IA族;
(2)B与D可形成非极性分子X为CO2;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大;
(4)G的最高价氧化物为SiO2,与B的单质(碳)在高温下能发生置换反应生成Si与CO;
(5)由H、N、O三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,则Z为NH4NO3,溶液中铵根离子水解破坏水的电离破坏,溶液呈酸性;
(6)盐Y由C、O、Na组成,则Y为Na2CO3,以熔融盐Na2CO3为电解质、氢气、氧气构成的燃料电池,由图可知石墨(I)是氢气失去电子,与碳酸结合生成水与二氧化碳;
(7)电解发生反应:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,相当于从溶液中析出CuO、失去部分水,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,将Cu(OH)2可以改写为CuO.H2O,电解中生成Cu为0.1mol,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑中电解的水为0.1mol.
解答 解:A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,由元素再周期表中位置,可知A为H元素;B为碳元素,C为N元素;D为O元素;E为Na,F为Al;G为Si;H为S元素.
(1)E元素在周期表中的位置:第三周期第IA族,故答案为:第三周期第IA族;
(2)B与D可形成非极性分子X为CO2,电子式为 ,故答案为:
,故答案为: ;
;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Na+>Al3+,
故答案为:S2->Na+>Al3+;
(4)G的最高价氧化物为SiO2,与B的单质(碳)在高温下能发生置换反应,其化学反应方程式为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(5)由H、N、O三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,则Z为NH4NO3,溶液中铵根离子水解:NH4++H2O?NH3•H2O+H+,破坏水的电离破坏,溶液呈酸性,
故答案为:NH4++H2O?NH3•H2O+H+;
(6)盐Y由C、O、Na组成,则Y为Na2CO3,以熔融盐Na2CO3为电解质、氢气、氧气构成的燃料电池,由图可知石墨(I)是氢气失去电子,与碳酸结合生成水与二氧化碳,电极反应式:H2+CO32--2e-=H2O+CO2,
故答案为:H2+CO32--2e-=H2O+CO2;
(7)电解发生反应:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,相当于从溶液中析出CuO、失去部分水,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,将Cu(OH)2可以改写为CuO.H2O,电解中生成Cu为0.1mol,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑中电解的水为0.1mol,整个过程转移电子为0.1mol×2+0.1mol×2=0.4mol,
故答案为:0.4mol.
点评 本题结构性质位置关系综合应用、原电池、电解计算、盐类水解等,推断元素是解题关键,侧重考查学生分析推理能力,(7)中关键是明确溶液复原时少什么加什么原则,注意运用化学式改写进行解答,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制氯化铁溶液时需加入少量盐酸 | |
| B. | 金属钠保存在装有煤油的带玻璃塞的广口瓶中 | |
| C. | 保存液溴需用水封,放在带橡皮塞子的棕色细口瓶中 | |
| D. | 用稀硝酸洗去附在试管内壁的银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都有氧化反应发生 | |
| C. | 糖类、蛋白质都为高分子化合物 | |
| D. | 一氯甲烷、二氧化碳都是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


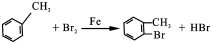 ,F的结构简式
,F的结构简式 .
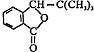
.
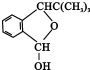 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M是阴离子交换膜 | B. | Y电极上产生无色气体 | ||
| C. | X电极区域可产生Mg(OH)2 | D. | X电极反应式为4OH--4e-═O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期金属元素的化合价越高,元素的金属性越强 | |
| B. | 海轮外壳上附着一些锌块,可以减缓海轮外壳的腐蚀 | |
| C. | 在含有 BaSO4 沉淀的溶液中加入 Na2SO4固体,c(Ba2+) 增大 | |
| D. | 2NO(g)+2CO(g)═N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将苯酚固体粉末沾在皮肤上,立即用大量热水(>65℃)冲洗 | |
| B. | 银氨溶液、Cu(OH)2悬浊液、氯水在实验室里均不宜长期放置 | |
| C. | 检验C2H5Cl中的氯元素:将C2H5Cl与NaOH溶液混合加热,冷却后加AgNO3溶液 | |
| D. | 同温下用pH试纸测定等浓度的NaClO溶液和CH3COONa溶液的pH,可以证明HClO和CH3COOH的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
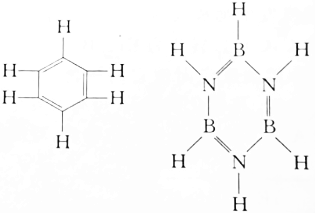
| A. | 前者大于后者 | B. | 前者等于后者 | C. | 前者小于后者 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com