
【题目】如图是恒温下某反应的化学反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( ) 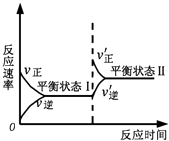
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
【答案】B
【解析】解:A.正逆反应速率相等,可逆反应达到平衡状态,为动态平衡状态,故A不选;
B.可逆反应中物质浓度与反应速率成正比,该反应达到平衡状态Ⅰ后,减小反应物浓度瞬间,正反应速率减小、逆反应速率不变,平衡发生移动,所以图象不符合,故B选;
C.增大反应物浓度瞬间,正反应速率增大、逆反应速率不变,平衡向正反应方向移动,从而达到新的平衡状态,新的平衡状态中浓度大于原来平衡状态,所以反应速率大于原来平衡状态,图象符合,故C不选;
D.物质浓度越大反应速率越大,根据图知,II状态反应速率大于I状态,所以II状态浓度大于I状态,符合图象,故D不选;
故选B.
可逆反应达到平衡状态时,正逆反应速率相等,为动态平衡状态;可逆反应中物质浓度与反应速率成正比,所以温度浓度越大,反应速率越大.


科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活的必需品,也是重要的化工原料.粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是粗盐提纯的操作流程.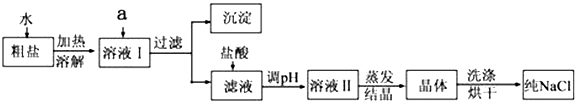
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液、稀盐酸.
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4 , 从提供的试剂中选出a所代表的试剂,试剂的选择和滴加顺序均正确的是:;
A.Na2CO3溶液、BaCl2溶液、NaOH溶液
B.溶液、NaOH溶液、K2CO3溶液
C.NaOH溶液、BaCl2溶液、Na2CO3溶液
D.Ba(NO3)2、NaOH溶液、Na2CO3溶液
E.BaCl2溶液、Na2CO3溶液、NaOH溶液
(2)过量碳酸盐溶液的作用是 .
(3)洗涤晶体操作使用的玻璃仪器有 .
(4)蒸发结晶的操作方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.生产K2FeO4的工艺流程如图所示: 
(1)写出“氧化”过程中生成Na2FeO4的化学方程式: .
(2)“转化”过程中发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所得出的相应结论正确的是( )
实验事实 | 结论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
C | 将Na2CO3溶液与苯酚悬浊液混合溶液变澄清 | 酸性:苯酚>HCO3- |
D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示.当溶液pH约为4时,停止反应.在20℃静置结晶,生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O.
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是 .
(3)析出固体的反应液经减压抽滤,洗涤,25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4 , 其可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修2:化学与技术]双氧水是一种重要的氧化剂、漂白剂和消毒剂.生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水.回答下列问题:
(1)蒽醌法制备H2O2理论上消耗的原料是 , 循环使用的原料是 , 配制工作液时采用有机溶剂而不采用水的原因是 .
(2)氢化物A中反应的化学方程式为 . 进入氧化塔C的反应混合液中的主要溶质为 .
(3)萃取塔D中的萃取剂是 , 选择其作萃取剂的原因是 .
(4)工作液再生装置F中要除净残留的H2O2 , 原因是 .
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为 , 一种双氧水的质量分数为27.5%(密度为1.10gcm﹣3),其浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1mol N2与4mol H2反应生成的NH3分子数为2NA
C.1mol Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题: 
(1)图中A点表示的意义是;
(2)图中B点表示的意义是;
(3)假如溶液中生成了沉淀0.39g,则此时用去NaOH溶液的体积最少是 . (写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com