
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 16克氧气和16克臭氧中所含原子数均为NA | |
| C. | 1mol氯气被氢氧化钠溶液完全吸收,转移的电子数为2NA | |
| D. | 标准状况下,44.8L水中所含的分子数为2NA |
分析 A、铵根离子中含11个质子;
B、氧气和臭氧均由氧原子构成;
C、氯气和碱的反应为歧化反应;
D、标况下水为液体.
解答 解:A、铵根离子中含11个质子,故1mol铵根离子中含11mol质子即11NA个,故A错误;
B、氧气和臭氧均由氧原子构成,故16g氧气和16g臭氧中含有的氧原子的物质的量均为1mol,个数均为NA个,故B正确;
C、氯气和碱的反应为歧化反应,故1mol氯气转移1mol电子即NA个,故C错误;
D、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴Ba(OH)2溶液,恰好使SO42-沉淀完全:2H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| B. | 向FeI2溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 加热可增强纯碱溶液去污力:CO32-+2H2O?H2CO3+2OH- | |
| D. | 过量CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
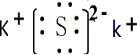 ,属于离子晶体.
,属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1L2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2NA | |
| B. | 7.8g苯中含有C=C键数目为0.3NA | |
| C. | 常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA | |
| D. | 用惰性电极电解1L浓度均为2mol•L-1的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | NO3- | C. | AlO2- | D. | HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
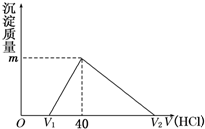 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )
将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )| A. | 图中m值为1.56 g | B. | 标准状况下产生氢气896 mL | ||
| C. | 图中V2为60 mL | D. | 原合金质量为0.92 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制自来水管不能与铜制水龙头连接 | |
| B. | 红热的铁丝与水接触,表面形成蓝黑色的保护层 | |
| C. | 白铁表面有划损时,也能阻止铁被腐蚀 | |
| D. | 家用炒菜铁锅用水清洗放置后,出现红棕色的锈渍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com