
����Ŀ������ֲ���纣���ͺ����к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ����������£�
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() �D��
�D��![]()
ij��ѧ��ȤС�齫�������̢ڢ���Ƴ�����ͼ��ʾ������

��֪���̢ڷ�����Ӧ�Ļ�ѧ����ʽΪCl2��2KI===2KCl��I2
�ش��������⣺
��1��д����ȡ���̢�������ʵ����������ƣ���_____________ ��_____________
��2�����Ȼ�̼��________ɫ���ܶȱ�ˮ________��Һ�塣F���²�Һ�����ɫΪ________ɫ���ϲ�Һ�������ʵ���Ҫ�ɷ�Ϊ________�����ѧʽ��
��3����F�еõ���̬�����еIJ�����___________________________��
��4�������չ����У�ʹ�õ���ʵ��������(����������)_______________(�����)��
���Թܡ� �ڴ����� ��������ǯ ���������� ���ݾƾ���
���𰸡� ���� ��ȡ �� �� �Ϻ�(����) KCl ��Һ������ �ڢۢ�
����������1��������ͼ����ʾ��֪�������ǹ��ˢ�����ȡ����2�����Ȼ�̼����ɫ���ܶȱ�ˮ���Һ�塣F���²�Һ������ȡ�˵�����Ȼ�̼��Һ������ɫΪ�Ϻ�(����)ɫ���ϲ�Һ�������ʵ���Ҫ�ɷ�ΪKCl����3����F�еõ���̬���ǽ���ȡҺ��ˮ��Һ�ֿ����ٰ���ȡҺ�еĵ�����Ȼ�̼���룬������еIJ����Ƿ�Һ��������4�������չ����У�ʹ�õ���ʵ��������������������Тڴ�������������ǯ���ݾƾ��ơ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ����һ����Ҫ��Դ��������������ʯ�Ͷ�ȱ���ͼ����ǵ��������½����Դ����ķ����������ǣ� ��
A.��ľ����ȼ��
B.���Ҵ��������
C.��������
D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������OH-�����·���ˮ�ⷴӦ��O2NC6H4COOC2H5(aq) +OH-(aq)![]() O2NC6H4COO-(aq)+C2H5OH(aq)�����ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.500mol��L-1����ͬ�¶��²��O2NC6H4COOC2H5��Ũ��(mol��L-1)��ʱ��仯���������±���ʾ�������й�˵������ȷ���ǣ�
O2NC6H4COO-(aq)+C2H5OH(aq)�����ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.500mol��L-1����ͬ�¶��²��O2NC6H4COOC2H5��Ũ��(mol��L-1)��ʱ��仯���������±���ʾ�������й�˵������ȷ���ǣ�
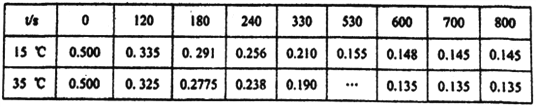
A. �����ݿ�֪���¶����߷�Ӧ���ʼӿ�
B. �����ݿ�֪�����ŷ�Ӧ�Ľ��У���Ӧ���Ũ�Ƚ��ͷ�Ӧ���ʼ���
C. 530sʱ��������35���Ӧ������һ����0.135
D. �÷�Ӧ��15�棬120s~180s �����v(O2NC6H4COOC2H5)ƽ����Ӧ����7.33��10-4mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ����ɵĻ�����M����ij�־��������ѧ���ʵ����͵��Ӳ��ϵ���Ҫ�ɷ֡����Ʊ��������£�
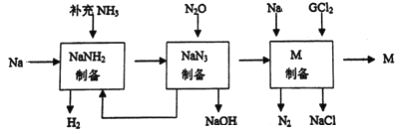
ȡ2.38g ��M ������ϡ�����ܽ⣬�����÷�ӦҺ�м���������NaOH��Һ�������д̼�����ζ����ʹʪ���ɫʯ����ֽ���������������ͬʱ��Һ�в�����ɫ������Ѹ�ٱ�ɻ���ɫ�����ձ�Ϊ���ɫ���������պ�����Ϊ3.20g����ش�
��1��д��NaNH2�ĵ���ʽ________�� M�Ļ�ѧʽ________________��
��2������ͼʾ��Ϣ����һ����ѧ����ʽ��ʾNaN3�Ʊ�����_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�������ýȾ�����л��ϳ��ϵ��Ȼ���������ˮ���Ȼ�����¶�ڿ�����������е�ˮ�ַ�Ӧ���ɰ�ɫ��������ǿ�ҵĴ̼�����ζ��ʵ����������װ��ģ��ϳ����Ȼ��������Ƚ����������ڣ�Ȼ��������ˮ���Ƴ���������������������뷴Ӧ��B�У�����Ӧ���л���ͨ�����������
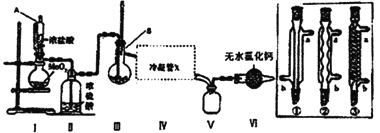
�����ּг�װ�ü���������ʡ�ԣ�
���������������£�
���� | ״̬ | �۵�/�� | �е�/�� |
Sn | ����ɫ���� | 232 | 2260 |
SnCl2 | ��ɫ���� | 246 | 652 |
SnCl4 | ��ɫҺ�� | -33 | 114 |
�ش��������⣺
��1������A������Ϊ_____________________������������Ӧѡ��________________________��
��2��װ��I�з�����Ӧ�����ӷ���ʽΪ______________________________��
��3��SnCl4�ڿ�������ˮ������Ӧ���ɰ�ɫSnO2��xH2O���壬�䷴Ӧ�Ļ�ѧ����ʽΪ__________________________________��
��4����װ�ô��ڵ�ȱ����_________________________��
��5������˵����ȷ����__________��
A.������Ӧ��ȼ�ƾ����ٵ�ȼ�ƾ���
B.����������������Ŀ����ҪΪ�����ѧ��Ӧ����
C.��ʵ��Ӧ����ͨ����ڻ���ͨ��ĵط�����
D.����Ʒ�������ᣬ������ˮ��⣬����ˮ��ɫ��ȥ��˵��SnCl4�к���SnCl2
E.����Ӧע���ڼ���֮ǰ�Ƚ�ͨ��ȴˮ����ֹͣ���Ⱥ���Ҫ����ͨ��ȴˮһ��ʱ��
��6����Ʒ�к�����SnCl2���ⶨSnCl4���ȵķ�����ȡ0.200g��Ʒ����50mL��ϡ�����У����������Һ��ָʾ������0.0100mol/L����ر���Һ�ζ����յ㣬���ı�Һ4.00 mL����Ӧԭ��Ϊ��3SnCl2+KIO3+6HC1=3SnCl4+KI+3H2O���жϵζ��յ������Ϊ_____________����Ʒ�Ĵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪As2O3��Zn���Է������·�Ӧ��As2O3+6Zn+6H2SO4![]() 2AsH3��+6ZnSO4+3H2O��
2AsH3��+6ZnSO4+3H2O��
(1)����˫���ŷ��������ת�Ƶķ������Ŀ____________________________________��
(2)As2O3��������Ӧ����ʾ������������____________(�����)��
A�������� B����ԭ�� C������ D������
(3)�÷�Ӧ������������__________����ԭ������________��
(4)������0.2 mol AsH3����ת�Ƶĵ�����Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����һ����ȾС��Ч�ʸߵ����ͻ�ѧ��Դ����Ӧ���ں������ϣ����ܷ�Ӧ�Ļ�ѧ����ʽΪ��2H2+O2=2H2O �õ�صĸ�����ӦʽΪ�ɱ�ʾΪ�� ��
A.2H2��4e��=4H+
B.4H++4e��=2H2
C.2H2O+O2+4e��=4OH��
D.4OH����4e��=2H2O+O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.����п�̵���Ƕ��ε��
B.Ǧ������һ�ε��
C.���ε���ֽ����أ����ŵ������ٳ��ʹ�������ʻ������
D.ȼ�ϵ�صĻ������ʴ��������ڵ���ڲ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com