
工业上利用可逆反应N2(g)+3H2(g)?2NH3(g)合成氨,下列叙述正确的是
A.恒温恒压条件下混合气体相对密度不再改变可以说明该反应已经达平衡状态
B.恒容通入氩气,使反应体系的压强增大,反应速率必定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.随着反应的进行,逆反应速率逐渐增大,正反应速率逐渐减小最后为0
科目:高中化学 来源:2014-2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷(解析版) 题型:填空题
(10分)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) == C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) == 2H2O(l) ΔH=-d kJ·mol-1 (a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 (填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量 (填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要 (填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是 。
(3)b 与a、c、d的数学关系式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省绍兴市高一上学期期中化学试卷(解析版) 题型:选择题
下列关于化学键的叙述正确的是
A.只有金属元素和非金属元素化合时才能形成离子键
B.单质分子中均存在化学键
C.阴阳离子间通过静电引力而形成的化学键叫做离子键
D.含有共价键的化合物不一定是共价化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高二上学期期中联考化学试卷(解析版) 题型:选择题
反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是
A.v(A)=0.15 mol·L-1·min-1
B.v(B)=0.015 mol·L-1·s-1
C.v(C)=0.40 mol·L-1·min-1
D.v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高二上学期期中联考化学试卷(解析版) 题型:选择题
下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度减小
C.SO2的催化氧化是一个放热的反应,所以升高温度,V逆加快,V正减慢
D.对于CaCO3+2HCl===CaCl2+H2O+CO2↑不能用CaCO3的浓度变化来表示反应速率,但可用水的浓度变化来表示
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高一上学期期中联考化学试卷(解析版) 题型:填空题
(3分)2.3g钠溶于水中形成溶液,所得溶液中Na+和H2O的个数比为1:100,则最初需要加入 克水。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高一上学期期中联考化学试卷(解析版) 题型:选择题
下列强酸性溶液中,能大量共存的是
A.Ca2+、K+、HCO3-、OH- B.Fe2+、Cl-、H+、MnO4-
C.Fe2+、Mg2+、Cl-、NO3- D.K+、NH4+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:填空题
(10分)某化学反应2A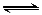 B+D在四种不同条件下进行,B、D起始浓度为0。反应物A 的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A 的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20 min时间内平均速率为 mol·(L·min)-1。
(2)在实验2中A的初始浓度C2= mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1?(填“>”“=”或“<”=,且C3 1.0 mol·L-1(填“>”“=”或“<”=。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A.1∶2 B.1∶4 C.3∶4 D.3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com